题目内容
【题目】下列解释事实的化学方程式或离子方程式中不正确的是
A. 盛放NaOH溶液的试剂瓶不能用玻璃塞:SiO2+2OH—=SiO32—+H2O
B. 用过氧化氢从酸化的海带灰浸出液中提取碘:2H++2I—+H2O2=I2+2H2O
C. 燃煤时加入适量石灰石粉末,可减少SO2的排放:2CaCO3+2SO2+O2![]() 2CaSO4+2CO2
2CaSO4+2CO2
D. 强碱溶液中,用次氯酸钠与Fe(OH)2反应制备高铁酸钠:2ClO—+ Fe(OH)2=FeO42—+2Cl—+2H+
【答案】D
【解析】
A.玻璃中的二氧化硅与氢氧化钠反应生成硅酸钠和水;B.双氧水能够将碘离子氧化成碘单质;C.在燃煤时加入适量石灰石粉末,反应生成硫酸钙、二氧化碳;D.强碱性溶液中,反应产物中不会存在氢离子。
因为二氧化硅与氢氧根离子发生反应SiO2+2OH﹣═SiO32﹣+H2O,则盛放NaOH溶液的试剂瓶不能用玻璃塞,A正确;用过氧化氢从酸化的海带灰浸出液中提取碘,该反应的离子方程式为: 2H++2I﹣+H2O2═I2+2H2O,B正确;在燃煤时加入适量石灰石粉末,可减少SO2的排放,该反应的化学方程式为: 2CaCO3+2SO2+O2![]() 2CaSO4+2CO2,C正确;强碱溶液中,用次氯酸钠与Fe(OH)2反应产物中不会存在氢离子,正确的离子方程式为: 2ClO﹣+Fe(OH)2+2OH-═FeO42﹣+2Cl﹣+2H2O, D错误;正确选项D。
2CaSO4+2CO2,C正确;强碱溶液中,用次氯酸钠与Fe(OH)2反应产物中不会存在氢离子,正确的离子方程式为: 2ClO﹣+Fe(OH)2+2OH-═FeO42﹣+2Cl﹣+2H2O, D错误;正确选项D。

【题目】锂及锂盐具有的优异性能和特殊功能,在化工、电子、宇航、核能、能源等领域都得到广泛应用;锂元素更是被誉为“能源元素”。
Ⅰ、锂的原子结构示意图为___________;锂在空气中燃烧,发出浅蓝色的火焰,放出浓厚的白烟,生成相应氧化物____________(填化学式)。
Ⅱ、锂经常用于制作电池。锂锰电池的体积小、性能优良,是常用的一次电池。该电池反应原理如图所示,其中电解质LiClO4溶于混合有机溶剂中,Li+通过电解质迁移入MnO2晶格中,生成LiMnO2。回答下列问题:
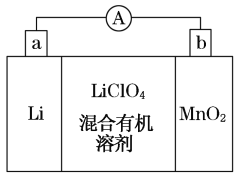
(1)外电路的电流方向是由________极流向________极。(填字母)
(2)电池正极反应式____________________________________。
(3)是否可用水代替电池中的混合有机溶剂?________(填“是”或“否”),用化学反应方程式解释原因______________________________________________。
Ⅲ、下面是从锂辉石(Li2O·Al2O3·SiO2)中提取锂的工业流程示意图。
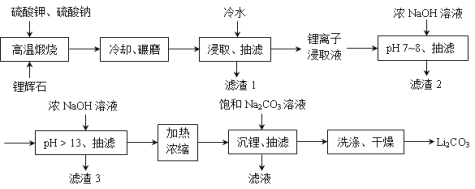
① 高温煅烧时的反应原理为:Li2OAl2O3SiO2+K2SO4= K2OAl2O3SiO2+Li2SO4;
Li2OAl2O3SiO2+Na2SO4= Na2OAl2O3SiO2+Li2SO4。
②锂离子浸取液中含有的金属离子为:K+、Na+、Li+、Fe3+、Fe2+、Al3+、Mn2+ 。
③几种金属离子沉淀完全的pH
金属离子 | Al(OH)3 | Fe(OH)2 | Fe(OH)3 | Mn(OH)2 |
沉淀完全的pH | 4.7 | 9.0 | 3.2 | 10.1 |
④Li2SO4、Li2CO3在不同温度下的溶解度(g / 100g水)
温度 溶解度 | 10 | 20 | 50 | 80 |
Li2SO4 | 35.4 | 34.7 | 33.1 | 31.7 |
Li2CO3 | 1.43 | 1.33 | 1.08 | 0.85 |
(1)浸取时使用冷水的原因是______________________________________。
(2)滤渣2的主要成分为__________________。
(3)流程中分2次调节pH(pH7~8和pH > 13),有研究者尝试只加一次浓NaOH溶液使pH > 13,结果发现在加饱和碳酸钠溶液沉锂后,随着放置时间延长,白色沉淀增加,最后得到的Li2CO3产品中杂质增多。Li2CO3产品中的杂质可能是__________________,用离子方程式表示其产生的原因_____________________________。
(4)洗涤Li2CO3晶体使用_____________。(填“冷水”或“热水”)
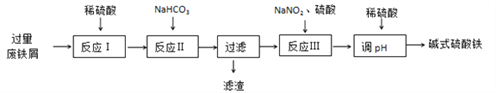
【题目】碱式硫酸铁[Fe(OH)SO4]可用做净水剂、媒染剂等。工业上利用废铁屑(含少量氧化铝、氧化铁等)生产碱式硫酸铁的部分工艺如下:
已知:部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
沉淀物 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 |
开始沉淀 | 2.3 | 7.5 | 3.4 |
完全沉淀 | 3.2 | 9.7 | 4.4 |
(1)反应Ⅰ中氧化还原反应的离子方程式__________________ 、 __________________。
(2)反应Ⅱ中加入NaHCO3调节体系的pH在_____________范围内。
(3)反应Ⅲ中生成的气体遇空气变红棕色,该反应的离子方程式是_________________。
(4)若反应Ⅲ中通入O2可减少NaNO2的用量,当消耗1molO2可节约n(NaNO2)=____mol。
(5)碱式硫酸铁溶于水后生成的Fe(OH)2+离子可部分水解生成Fe2(OH)42+ 聚合离子,该水解反应的离子方程式为____________________________