题目内容
【题目】侯氏制碱法的原理为:NH3+CO2+H2O+NaCl═NaHCO3↓+NH4Cl,2NaHCO3 ![]() Na2CO3+H2O+CO2↑,实验室模拟该过程包括制备NH3、制取NaHCO3、分离及灼烧NaHCO3四个步骤,下列图示装置能达到实验目的是( )
Na2CO3+H2O+CO2↑,实验室模拟该过程包括制备NH3、制取NaHCO3、分离及灼烧NaHCO3四个步骤,下列图示装置能达到实验目的是( )
A. 制备氨气
制备氨气
B.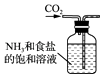 制取NaHCO3
制取NaHCO3
C.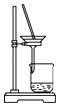 分离NaHCO3
分离NaHCO3
D.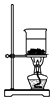 灼烧NaHCO3
灼烧NaHCO3
【答案】C
【解析】解:A.氯化铵分解生成氨气和氯化氢,在温度稍低时又生成氯化铵,不能得到氨气,制备氨气,应加热氯化铵和氢氧化钙固体,故A错误; B.应从长导管通入气体,防止压强过大,故B错误;
C.析出碳酸氢钠固体,可用过滤的方法分离,故C正确;
D.灼烧固体,不能用烧杯,以免炸裂,应在坩埚中进行,故D错误.
故选C.

 轻巧夺冠周测月考直通中考系列答案
轻巧夺冠周测月考直通中考系列答案【题目】人们常用催化剂来选择反应进行的方向.如图所示为一定条件下1mol CH3OH与O2发生反应时,生成CO、CO2或HCHO的能量变化图[反应物O2(g)和生成物H2O(g)略去].
(1)①在有催化剂作用下,CH3OH与O2反应主要生成(填“CO、CO2”或“HCHO”).2HCHO(g)+O2(g)═2CO(g)+2H2O(g)△H= .
②甲醇制取甲醛可用Ag作催化剂,含有AgCl会影响Ag催化剂的活性.用氨水可以溶解除去其中的AgCl,写出该反应的离子方程式: .
(2)已知:CO(g)+2H2(g)CH3OH(g)△H=﹣a kJmol﹣1 .
①经测定不同温度下该反应的平衡常数如下:
温度(℃) | 250 | 300 | 350 |
K | 2.041 | 0.270 | 0.012 |
若某时刻、250℃测得该反应的反应物与生成物的浓度为c(CO)=0.4molL﹣1、c(H2)=0.4molL﹣1、c(CH3OH)=0.8molL﹣1 , 则此时v正v逆(填“>”、“<”或“=”).
②某温度下,在体积固定的2L的密闭容器中将1mol CO和2mol H2混合,测得不同时刻的反应前后压强关系如下:
时间(min) | 5 | 10 | 15 | 20 | 25 | 30 |
压强比(P后/P前) | 0.98 | 0.90 | 0.80 | 0.70 | 0.70 | 0.70 |
则0~15min,用H2表示的平均反应速率为 , 达到平衡时CO的转化率为 .
(3)利用钠碱循环法可除去SO2 , 消除SO2对环境的污染.吸收液吸收SO2的过程中,pH随n(SO32﹣):n(HSO3﹣)变化关系如下表:
n(SO32﹣):n(HSO3﹣) | 91:9 | 1:1 | 1:91 |
pH | 8.2 | 7.2 | 6.2 |
①根据上表判断NaHSO3溶液显性.
②在NaHSO3溶液中离子浓度关系正确的是 (填字母).
a.c(Na+)=2c(SO32﹣)+c(HSO3﹣)
b.c(Na+)>c(HSO3﹣)>c(H+)>c(SO32﹣)>c(OH﹣)
c.c(H2SO3)+c(H+)=c(SO32﹣)+(OH﹣)
d.c(Na+)+c(H+)=c(SO32﹣)+c(HSO3﹣)+c(OH﹣)

