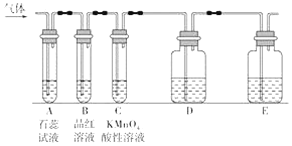
题目内容
【题目】已知在温度T1和T2时水的电离平衡曲线如图所示,下列说法错误的是( )
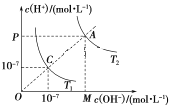
A.水的离子积常数关系为:C<A
B.升高温度可实现由C点到A点
C.T2时,pH=4的硫酸与pH=10的氢氧化钠溶液等体积混合,所得溶液的pH=7
D.图中矩形OMAP的面积表示T2时水的离子积的值
【答案】C
【解析】
A.C点条件下Kw=c(H+)×c(OH-)=10-7×10-7=10-14,因为A点氢离子和氢氧根离子浓度都比C点大,所以水的离子积常数Kw,C<A,故A正确;
B.升高温度,促进水的电离,所以溶液中的氢离子和氢氧根浓度都增大,所以可实现由C点到A点,故B正确;
C.T2时Kw=c(H+)×c(OH-)>10-14,pH=10的氢氧化钠中含氢氧根离子的浓度为:c(OH-)>1×10-4mol/L;pH=4的H2SO4溶液含氢离子的浓度为:c(H+)=1×10-4mol/L,二者等体积混合,所以n(OH-)>n(H+),溶液呈碱性,pH≠7,故C错误;
D.图中矩形OMAP的面积即为A点c(H+)×c(OH-),所以矩形OMAP的面积表示T2时水的离子积的值,故D正确;
故选C。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】氮、磷、钾是农作物生长的必须营养元素,磷和钙都是促成骨骼和牙齿的钙化不可缺少的营养元素。回答下列问题:
(1)基态K的核外电子排布式为____________,基态N的价电子排布图为____________。
(2)元素的第一电离能:Ca________(填“>”或“<”)P。
(3)白磷P4在CS2中的溶解度________(填“大于”或“小于”)在水中的溶解度,N4是氮的一种新型单质,若N4分子结构类似于白磷P4,则N的杂化方式为________。
(4)下表是几种碳酸盐的热分解温度和阳离子半径:
碳酸盐 | CaCO3 | SrCO3 | BaCO3 |
热分解温度/℃ | 900 | 1172 | 1360 |
阳离子半径/pm | 99 | 112 | 135 |
根据上表数据分析碳酸钡分解温度最高的原因是_______________________
(5)常温下PCl5是一种白色晶体,晶体结构为氯化铯型,由A、B两种离子构成。已知A、B两种离子分别与CCl4、SF6互为等电子体,则A、B两种离子的符号分别为________、________。
(6)用晶体的X射线衍射法可以测得阿伏加德罗常数的值。已知金属钙的晶胞为面心立方(如图)晶胞,晶胞边长为d pm;又知钙的密度为ρ g/cm3,则一个钙晶胞的质量为________(用d、ρ表示,下同)g,阿伏加德罗常数的值为______________(化成最简式)。