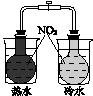
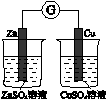题目内容
用CH4催化还原NOx可以消除氮氧化物的污染。
例如:CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) ΔH1=-574 kJ·mol-1
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) ΔH2=-1 160 kJ·mol-1
若在标准状况下用CH4还原4.48 L NO2生成N2,则下列说法中正确的是
( )。
例如:CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) ΔH1=-574 kJ·mol-1
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) ΔH2=-1 160 kJ·mol-1
若在标准状况下用CH4还原4.48 L NO2生成N2,则下列说法中正确的是
( )。
| A.该过程吸收的热量为86.7 kJ |
| B.此过程中需要标准状况下CH4气体1.12 L |
| C.转移的电子数为0.8NA |
| D.已知2NO(g)+O2(g)=2NO2(g) ΔH=-114 kJ·mol-1,则CH4的燃烧热是802 kJ·mol-1 |
C
根据盖斯定律将两个热化学方程式相加并除以2可得:CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g) ΔH2=-867 kJ·mol-1,为放热反应,A项错误;B项计算错误,应需要标准状况下2.24 L CH4;表示甲烷燃烧热必须是生成液态水,由所给条件不能计算,故D项错误。

练习册系列答案
相关题目
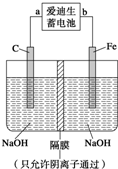
 3Z(g),b的压强一定比a大
3Z(g),b的压强一定比a大
 2AB3(g)的ΔH<0
2AB3(g)的ΔH<0