题目内容
【题目】高铁酸盐是一种新型绿色净水消毒剂,热稳定性差,在碱性条件下能稳定存在,溶于水发生反应:4FeO42-+10H2O=4Fe(OH)3+3O2↑+8OH-。回答下列问题:
(1)工业上湿法制备高铁酸钾(K2FeO4)的工艺如图:
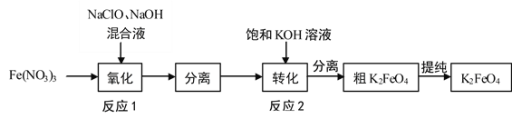
①Na2FeO4中铁元素的化合价为___,高铁酸钠用于杀菌消毒时的化学反应类型为___(填“氧化还原反应”、“复分解反应”或“化合反应”)。
②反应2加入饱和KOH溶液可转化析出K2FeO4,理由是__。
(2)化学氧化法生产高铁酸钠(Na2FeO4)是利用Fe(OH)3、过饱和的NaClO溶液和NaOH浓溶液反应,该反应的化学方程式为___;理论上每制备0.5mol的Na2FeO4消耗NaClO的质量为___(保留小数点后1位)。
(3)采用三室膜电解技术制备Na2FeO4的装置如图甲所示,阳极的电极反应式为__。电解后,阴极室得到的A溶液中溶质的主要成分为___(填化学式)。
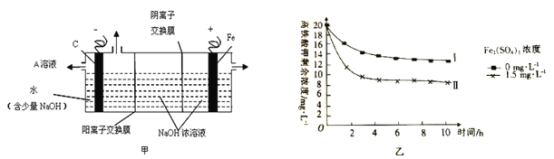
(4)将一定量的K2FeO4投入一定浓度的Fe2(SO4)3溶液中,测得剩余K2FeO4浓度变化如图乙所示,推测曲线I和曲线Ⅱ产生差异的原因是___。
【答案】+6 氧化还原反应 该温度下Na2FeO4的溶解度大于K2FeO4 2Fe(OH)3+3NaClO+4NaOH=2Na2FeO4+3NaCl+5H2O 55.9g Fe+8OH--6e-=FeO42-+4H2O NaOH Fe2(SO4)3溶液水解显酸性,促进K2FeO4与水反应,从而降低K2FeO4的浓度
【解析】
(1)反应1中发生反应的化学方程式为2Fe(OH)3+3NaClO+4NaOH=2Na2FeO4+3NaCl+5H2O,向分离出的Na2FeO4中加入饱和KOH溶液反应生成粗K2FeO4;
(2)Fe(OH)3、过饱和的NaClO溶液和NaOH浓溶液反应生成Na2FeO4,同时生成还原产物NaCl,结合守恒法写出该反应的化学方程式;根据电子守恒计算制备0.5molNa2FeO4消耗NaClO的质量;
(3)电解时,阳极发生氧化反应生成FeO42-,阴极生成氢气和氢氧化钠;
(4)由图可知,Fe2(SO4)3浓度越大,K2FeO4浓度越小,与铁离子的水解有关。
(1)①Na2FeO4中钠元素的化合价为+1价,氧元素的化合价为-2价,根据化合物中元素的正负化合价代数和为0,则铁元素的化合价为0-(-2)×4-(+1)×2=+6价;高铁酸钠中铁元素为+6价,具有强氧化性,能杀菌消毒,故高铁酸钠用于杀菌消毒时的化学反应类型为发生氧化还原反应;
②反应2加入饱和KOH溶液可转化析出K2FeO4,即加入饱和KOH溶液发生的反应为Na2FeO4+2KOH=K2FeO4↓+2NaOH,说明该温度下高铁酸钾的溶解度小于高铁酸钠的溶解度;
(2)Fe(OH)3、过饱和的NaClO溶液和NaOH浓溶液反应生成Na2FeO4,反应中Fe元素的化合价从+3价升高为+6价,Cl元素的化合价从+1价降为-1价,根据得失电子守恒、原子守恒,则该反应的化学方程式为2Fe(OH)3+3NaClO+4NaOH=2Na2FeO4+3NaCl+5H2O;设制备0.5mol的Na2FeO4消耗NaClO的质量为mg,则由电子守恒可知:0.5mol×3=![]() [(+1)-(-1)],解得:m≈55.9;
[(+1)-(-1)],解得:m≈55.9;
(3)根据装置图,Fe为阳极,电解时,阳极发生氧化反应生成FeO42-,电极方程式为Fe-6e-+8OH-=FeO42-+4H2O;阴极电极反应式为2H2O+2e-=H2↑+2OH-,阴极生成氢气和氢氧化钠,则阴极室得到的A溶液中溶质的主要成分为NaOH;
(4)由图可知,Fe2(SO4)3浓度越大,K2FeO4浓度越小,根据“高铁酸盐在碱性条件下能稳定存在,溶于水发生反应:4FeO42-+10H2O=4Fe(OH)3+3O2↑+8OH-”,则产生曲线Ⅰ和曲线Ⅱ差异的原因是Fe2(SO4)3溶液水解显酸性,促进K2FeO4与水反应从而降低K2FeO4浓度。

【题目】工业上可用一氧化碳合成可再生能源甲醇。
(1)已知:Ⅰ.3CO(g)+6H2(g) ![]() CH3CH=CH2(g)+3H2O(g) △H1=-301.3kJ/mol;
CH3CH=CH2(g)+3H2O(g) △H1=-301.3kJ/mol;
Ⅱ.3CH3OH(g) ![]() CH3CH=CH2(g)+3H2O(g) △H2=-31.0kJ/mol。
CH3CH=CH2(g)+3H2O(g) △H2=-31.0kJ/mol。
则CO与H2合成气态甲醇的热化学方程式为___________________________________
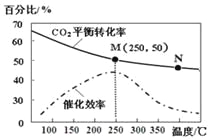
(2)某科研小组在Cu2O/ZnO作催化剂的条件下,在500℃时,研究了n(H2)∶n(CO)分别为2∶1、5∶2时CO的转化率变化情况(如图1所示),则图中表示n(H2)∶n(CO)=2∶1的变化曲线为________(填“曲线a”或“曲线b”),原因是_________________。

(3)某科研小组向密闭容器中充入一定量的CO和H2合成气态甲醇,分别在A、B两种不同催化剂作用下发生反应,一段时间后测得CH3OH的产率与温度的关系如图2所示。下列说法正确的是____________(填选项字母)。
a.使用催化剂A能加快相关化学反应速率,但催化剂A并未参与反应
b.在恒温恒压的平衡体系中充入氩气,CH3OH的产率降低
c.当2v(CO)正=v(H2)逆时,反应达到平衡状态
(4)一定温度下,在容积均为2L的两个恒容密闭容器中,按如下方式加入反应物,一段时间后达到平衡。
容器 | 甲 | 乙 |
反应物起始投入量 | 2 mol CO、6 mol H2 | a mol CO、b mol H2、c mol CH3OH(g)(a、b、c均不为零) |
若甲容器平衡后气体的压强为开始时的![]() ,则该温度下,该反应的平衡常数K=_______,要使平衡后乙容器与甲容器中相同组分的体积分数相等,且起始时维持化学反应向逆反应方向进行,则乙容器中c的取值范围为_____________________________________。
,则该温度下,该反应的平衡常数K=_______,要使平衡后乙容器与甲容器中相同组分的体积分数相等,且起始时维持化学反应向逆反应方向进行,则乙容器中c的取值范围为_____________________________________。
(5)CO与日常生产生活相关。

①检测汽车尾气中CO含量,可用CO分析仪,工作原理类似于燃料电池,其中电解质是氧化钇(Y2O3)和氧化锆(ZrO2)晶体,能传导O2-。则负极的电极反应式为__________________。
②碳酸二甲酯[(CH3O)2CO]毒性小,是一种绿色化工产品,用CO合成(CH3O)2CO,其电化学合成原理为4CH3OH+2CO+O2![]() 2(CH3O)2CO+2H2O,装置如图3所示:写出阳极的电极反应式:________________________________________
2(CH3O)2CO+2H2O,装置如图3所示:写出阳极的电极反应式:________________________________________