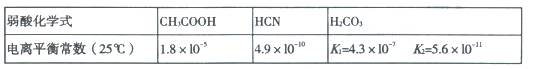
题目内容
室温下,下列混合溶液中,各离子浓度的关系正确的是( )
c(Na+)=c(CH3COO-)>c(OH—)=c(H+)
| A.浓度均为0.1mol·L-1的小苏打溶液与烧碱溶液等体积混合: 2c(CO32-)+c(OH-)+c(HCO3-)—c(H+)=0.1mol·L-1 |
| B.浓度均为0.1mol·L-1的硫酸氢铵溶液与氢氧化钠溶液等体积混合 c(SO42-)>c(Na+)>c(NH4+)>c(H+)>c(OH-) |
| C.pH=12的氨水与pH =2的盐酸等体积混合 c(Cl-)>c(NH4+)>c(OH-)>c(H+) |
| D.浓度均为0.1mol·L-1的醋酸溶液与氢氧化钠溶液等体积混合 |
A
此题考查水溶液的离子浓度的比较知识。浓度均为0.1mol·L-1的小苏打溶液与烧碱溶液等体积混合后,溶液存在的离子为:CO32-、OH-、HCO3-、H+和Na+,根据溶液中阴阳离子所带的电荷守恒,可知2c(CO32-)+c(OH-)+c(HCO3-)=c(H+)+ c(Na+),而其中的c(Na+)=0.1mol·L-1,可得:2c(CO32-)+c(OH-)+c(HCO3-)—c(H+)=0.1mol·L-1,A对;浓度均为0.1mol·L-1的硫酸氢铵溶液与氢氧化钠溶液等体积混合后得到的是等物质的量的硫酸钠和硫酸铵的混合溶液,故其中:c(SO42-)=c(Na+),B错;pH=12的氨水与pH =2的盐酸等体积混合,氨水是弱碱盐酸是强酸,故反应后氨水过量,溶液呈碱性,溶液中:c(NH4+)>c(Cl-)> c(OH-)>c(H+),C错;浓度均为0.1mol·L-1的醋酸溶液与氢氧化钠溶液等体积混合,得到的是醋酸钠溶液,其属于强碱弱酸盐,故溶液呈碱性,其中:c(OH—)>c(H+),D错。

练习册系列答案
相关题目