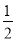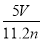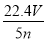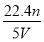题目内容
已知:常温下,0.01 mol/L MOH溶液的pH为10,MOH(aq)与H2SO4(aq)反应生成1 mol正盐的ΔH=-24.2 kJ·mol-1,强酸与强碱的稀溶液的中和热为ΔH=-57.3 kJ·mol-1。则MOH在水溶液中电离的ΔH为( )
A.-69.4 kJ·mol-1 B.-45.2 kJ·mol-1
C.+69.4 kJ·mol-1 D.+45.2 kJ·mol-1
D
【解析】 依题意,MOH是弱碱:MOH(aq)+H+(aq)=M+(aq)+H2O(l) ΔH1=-12.1 kJ·mol-1①,
H+(aq)+OH-(aq)=H2O(l) ΔH2=-57.3 kJ·mol-1②,
根据盖斯定律,由①-②得:MOH(aq)??M+(aq)+OH-(aq) ΔH=(-12.1+57.3)kJ/mol=+45.2 kJ/mol。

 综合自测系列答案
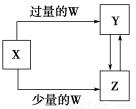
综合自测系列答案短周期元素R、T、Q、W在元素周期表中的相对位置如图所示,其中T所处的周期序数与族序数相等。下列判断不正确的是( )
|
| R |
|
T | Q |
| W |
A.最简单气态氢化物的热稳定性:R>Q
B.最高价氧化物对应水化物的酸性:Q<W
C.原子半径:T>Q>R
D.含T的盐溶液一定显酸性
某工业废水仅含下表中的某些离子,且各种离子的物质的量浓度相等,均为0.1 mol/L(此数值忽略水的电离及离子的水解)。
阳离子 | K+ Ag+ Mg2+ Cu2+ Al3+ NH4+ |
阴离子 | Cl- CO32— NO3— SO42— SiO32— I- |
甲同学欲探究废水的组成,进行了如下实验:
Ⅰ.取该无色溶液5 mL,滴加一滴氨水有沉淀生成,且离子种类增加。
Ⅱ.用铂丝蘸取溶液,在火焰上灼烧,透过蓝色钴玻璃观察,无紫色火焰。
Ⅲ.另取溶液加入过量盐酸,有无色气体生成,该无色气体遇空气变成红棕色。
Ⅳ.向Ⅲ中所得的溶液中加入BaCl2溶液,有白色沉淀生成。
请推断:
(1)由Ⅰ、Ⅱ判断,溶液中一定不含有的阳离子是____________。
(2)Ⅲ中加入盐酸生成无色气体的离子方程式是
___________________________________________________________。
(3)甲同学最终确定原溶液中所含阳离子有________,阴离子有________;并据此推测原溶液应该呈_______________________________________________性,原因是_________________________________(请用离子方程式说明)。
(4)另取100 mL原溶液,加入足量的NaOH溶液,此过程中涉及的离子方程式为__________________________________________________________。
充分反应后过滤,洗涤,灼烧沉淀至恒重,得到的固体质量为________g。