题目内容
【题目】硫酸亚铁铵(NH4)2Fe(SO4)2·6H2O是一种浅绿色晶体,在水中的溶解度较小,不溶于乙醇。某实验小组利用镀锌铁片来制备硫酸亚铁铵的过程如下:
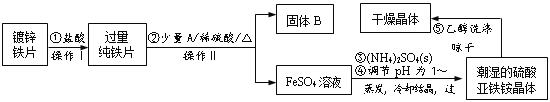
(1)加入盐酸的目的是___。
(2)A物质可以是___(选填序号)。
a.CuCl2 b.CuO c.Cu(NO3)2 d.CuSO4
加入少量A物质的目的是___。
(3)操作Ⅱ的名称为___。
(4)采用晾干而不用加热烘干晶体的原因是___。
(5)工业上常用K2Cr2O7溶液测定硫酸亚铁铵的纯度,反应中Cr2O72-被还原成Cr3+。写出硫酸亚铁铵溶液与酸性K2Cr2O7溶液反应的离子方程式___。
【答案】为了除去锌镀层 bd 加快铁与稀硫酸的反应速率 过滤 避免加热过程中晶体受热分解失去结晶水或被空气氧化 6Fe2++Cr2O72-+14H+=2Cr3++6Fe3++7H2O
【解析】
(1)盐酸可以除去锌镀层;
(2)加入的物质与稀硫酸反应后的物质能与铁反应且不引入新的杂质;
(3)分离固体和溶液用过滤的方法;
(4)硫酸亚铁铵晶体受热易分解且易被氧化;
(5)K2Cr2O7溶液测定硫酸亚铁铵的纯度,反应中Cr2O72-被还原成Cr3+,亚铁离子被氧化生成铁离子。
(1)加入盐酸是为了除去锌镀层;
(2)加入的物质与稀硫酸反应后的物质能与铁反应且不引进新的杂质,ac能引进新的杂质离子,bd不能引进新的杂质离子,故选bd;加入少量A,A中含有铜离子,铜离子和铁反应生成铜,铜、铁和酸能构成原电池,从而加快铁与稀硫酸的反应速率;
(3)分离固体和溶液的方法是过滤;
(4)如果采用加热的方法制取硫酸亚铁铵,加热过程中,硫酸亚铁铵易失水,且亚铁离子易被氧气氧化,从而得不到硫酸亚铁铵晶体;
(5)K2Cr2O7溶液测定硫酸亚铁铵的纯度,反应中Cr2O72-被还原成Cr3+,亚铁离子被氧化生成铁离子,离子反应方程式为:6Fe2++Cr2O72-+14H+=2Cr3++6Fe3++7H2O。

 高效智能课时作业系列答案
高效智能课时作业系列答案 捷径训练检测卷系列答案
捷径训练检测卷系列答案 小夫子全能检测系列答案
小夫子全能检测系列答案