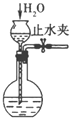
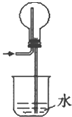
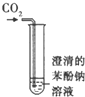
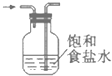
题目内容
【题目】下列有关叙述中正确的是( )
A.常温下,pH=4的CH3COOH与CH3COONa混合溶液中:c(Na+)<c(CH3COO-)
B.NaCl溶液和CH3COONH4溶液均显中性,两溶液中水的电离程度相同
C.已知25℃时NH4CN溶液显碱性,则25℃时的电离平衡常数K(NH3·H2O)<K(HCN)
D.0.1mol/L醋酸溶液加少量水稀释![]() 增大
增大
【答案】A
【解析】
A. 常温下,pH=4的CH3COOH与CH3COONa混合溶液呈酸性,则c(H+)>c(OH),根据电荷守恒c(H+)+ c(Na+)= c(OH)+ c(CHCOO),可知:c(Na+)<c(CHCOO),故A正确;
B. NaCl溶液和CH3COONH4溶液均显中性,氯化钠溶液对水的电离无影响,而醋酸根离子、铵根离子发生水解,促进了水的电离,故B错误;
C. 已知25℃时NH4CN溶液显碱性,说明CN离子水解程度大于NH4+离子,HCN酸性弱,电离程度小,则25℃时的电离常数:K(NH3H2O)>K(HCN),故C错误;
D. 醋酸中加入少量水后,醋酸的电离程度增大,则溶液中醋酸的物质的量减小,氢离子的物质的量增大,由于在同一溶液中,则![]() 的比值减小,故D错误;
的比值减小,故D错误;
答案选A。

 一线名师权威作业本系列答案
一线名师权威作业本系列答案【题目】结合下表回答下列问题(均为常温下的数据):
酸 | 电离常数(Ka) | 酸 | 电离常数(Ka) | 酸 | 电离常数(Ka) | 酸 | 电离常数(Ka) |
CH3COOH | 1.8×10-5 | H2CO3 | K1=4.4×10-7 | H2C2O4 | K1=5.4×10-2 | H2S | K1=1.3×10-7 |
HClO | 3×10-8 | K2=4.7×10-11 | K2=5.4×10-5 | K2=7.1×10-15 |
请回答下列问题:
(1) 同浓度的CH3COO-、HCO3-、CO32-、HC2O4-、ClO-、S2-中结合H+的能力最弱的是_________。
(2) 0.1mo1/L的H2C2O4溶液与0.1mo1/L的KOH的溶液等体积混合后所得溶液呈酸性,该溶液中各离子浓度由大到小的顺序为________________。
(3)pH相同的NaC1O和CH3COOK溶液中,[c(Na+)-c(C1O-)]______[c(K+)-c(CH3COO-)](填“>”、“<”或“=”) 。
(4) 向0.1mo1/LCH3COOH 溶液中滴加NaOH 溶液至c(CH3COOH): c(CH3COO-)=5:9,此时溶液pH=_________。
【题目】一定温度下,在3个体积均为![]() 的密闭容器中反应
的密闭容器中反应![]()
![]() 达到平衡,下列说法正确的是
达到平衡,下列说法正确的是
容器 | 温度 | 物质的起始浓度 | ||
|
|
| ||
Ⅰ | 400 |
|
| 0 |
Ⅱ | 400 |
|
|
|
Ⅲ | 300 | 0 | 0 | td style="width:88.2pt; border-top-style:solid; border-top-width:0.75pt; border-left-style:solid; border-left-width:0.75pt; padding:3.38pt 5.03pt; vertical-align:middle">|
A.达到平衡时,向容器Ⅰ中通入氦气,正、逆反应速率均增大,平衡不移动
B.达到平衡时,容器Ⅱ中![]() 比容器Ⅰ中的大
比容器Ⅰ中的大
C.达到平衡时,容器Ⅲ中![]() 小于容器Ⅰ中
小于容器Ⅰ中![]() 的两倍
的两倍
D.容器中混合气体的密度不再发生变化可作为反应达到平衡状态的标志