题目内容
下列有关金属铁的腐蚀与防护,说法正确的是
| A.酸雨后易发生析氢腐蚀、炒锅存留盐液时易发生吸氧腐蚀 |
| B.当镀锡铁和镀锌铁镀层破损时,后者更易被腐蚀 |
| C.铁与电源正极连接可实现电化学保护 |
| D.将钢管与铜管一起堆放时可保护钢管少受腐蚀 |
A
解析试题分析:A. 酸雨后由于溶液显酸性,所以半径容易发生析氢腐蚀,而在炒锅存留盐液时由于溶液是中性溶液,因此较易发生吸氧腐蚀,正确;B.由于金属活动性Zn>Fe>Sn,所以镀锡铁镀层破损时,Fe作原电池的负极首先被腐蚀,而镀锌铁镀层破损时,由于Fe作正极,首先被腐蚀的是活动性强的Zn,故Fe就被保护起来。因此当镀锡铁和镀锌铁镀层破损时,前者更易被腐蚀,错误;C. 铁与电源负极连接可实现电化学保护,错误;D. 将钢管与铜管一起堆放时可使钢管受腐蚀的程度大大增加,错误。
考点:考查原电池反应在金属的腐蚀与保护中的作用的知识。

练习册系列答案
相关题目
碱性电池具有容量大、放电电流大的特点,因而得到广泛应用。锌—锰碱性电池以氢氧化钾溶液为电解液,电池总反应式为: Zn(s)+2MnO2(s)+H2O(l)==Zn(OH)2(s)+Mn2O3(s) ,下列说法错误的是( )
| A.电池工作时,锌失去电子 |
| B.电池正极的电极反应式为:2MnO2(s)+H2O(1)+2e—=Mn2O3(s)+2OH—(aq) |
| C.电池工作时,电子由正极通过外电路流向负极 |
| D.外电路中每通过0.2mol电子,锌的质量理论上减小6.5g |
高铁酸盐在能源环保领域有广泛用途。用镍(Ni)、铁做电极电解浓NaOH溶液制备高铁酸盐Na2FeO4的装置如图所示。下列推断合理的是( )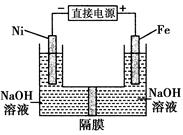
| A.铁是阳极,电极反应为Fe-6e-+4H2O===FeO+8H+ |
| B.镍电极上的电极反应为2H2O+2e-==H2↑+2OH- |
| C.若隔膜为阴离子交换膜,则OH-自右向左移动 |
| D.电解时阳极区pH降低、阴极区pH升高,最终溶液pH不变 |
把锌片和铜片用导线相连后插入稀硫酸溶液中构成原电池。对该电池的描述合理的是①溶液中硫酸的物质的量浓度保持不变;②Cu极上有气泡产生,发生还原反应;③Cu为负极,Zn为正极;④原电池在工作时电子由负极通过溶液流向正极;⑤该装置将化学能转变为电能( )
| A.④⑤ | B.③⑤ | C.①② | D.②⑤ |
下图为一原电池的结构示意图,下列说法中,错误的是 
| A.Cu电极为正电极 |
| B.原电池工作时,电子从Zn电极流出 |
| C.原电池工作时的总反应为:Zn+Cu2+=Zn2++Cu |
| D.盐桥(琼脂-饱和KCl溶液)中的K+移向ZnSO4溶液 |
用惰性电极电解下列足量的溶液,一段时间后,再加入一定量的另一物质(括号内)后,溶液能与原来溶液浓度一样的是 ( )
| A.CuCl2(CuCl2溶液) | B.AgNO3(Ag2O) | C.NaCl(HCl溶液) | D.CuSO4(Cu(OH)2) |