题目内容
能用离子方程式H+ + OH- = H2O表示的是
| A.Ba(OH)2溶液和H2SO4溶液混合 |
| B.NaOH溶液和盐酸混合 |
| C.Cu(OH)2和稀H2SO4反应 |
| D.CO2通入NaOH溶液中 |
B
解析试题分析:A、Ba(OH)2溶液和H2SO4溶液反应除水外还有硫酸钡生成,错误;B、NaOH溶液和盐酸反应的实质就是氢离子与氢氧根离子结合生成水,正确;C、Cu(OH)2和稀H2SO4反应的离子方程式中Cu(OH)2不能拆开,错误;D、CO2是非金属氧化物,在书写离子方程式时不能拆开,错误,答案选B。
考点:考查离子方程式的意义

练习册系列答案
 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案
相关题目
下列反应的离子方程式正确的是
A.Na2CO3溶液与NaHSO4溶液反应: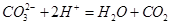 ↑ ↑ |
B.向硫酸铵溶液中加入氢氧化钡溶液: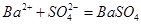 ↓ ↓ |
| C.Fe3O4与稀硝酸反应:Fe3O4 +8H+= 2Fe3++ Fe2+ +4H2O |
| D.少量金属钠加到冷水中:Na +2H2O=Na+ +OH- +H2↑ |
下列离子反应方程式正确的是( )
| A.氨水吸收过量的SO2:OH-+SO2=HSO3- |
| B.FeSO4溶液被氧气氧化:4Fe2++O2+2H2O=4Fe3++4OH- |
| C.NaAlO2溶液中加入过量稀硫酸:AlO2-+H++H2O=Al(OH)3↓ |
| D.Cl2与稀NaOH溶液反应:Cl2+2OH-=Cl-+ClO-+ H2O |
下列各组离子在常温下一定能大量共存的是
| A.pH=0的无色溶液中:Cl-、Na+、SO42-、Fe2+ |
| B.在c(H+)/c(OH-)=1012的溶液中:NH4+、NO3-、K+、Cl- |
| C.加入铝粉能放出H2的溶液中:Mg2+、NH4+、NO3-、Cl- |
| D.含有大量Fe3+的溶液中:Al3+、SCN-、Br-、Na+ |
在给定的四种溶液中,含有以下各种微粒,一定能大量共存的是 ( )
| A.由水电离的c(OH-)=1×10-12mol/L的溶液中:Ba2+、K+、Br-、SiO32- |
| B.常温下葡萄糖溶液中:SCN—、Cl-、K+、NH4+ |
| C.溴水中:Na+、CO32-、NH4+、SO42— |
| D.PH大于7的溶液: Na+、Ba2+、SO32-、ClO— |
有一未知的无色溶液,只可能含有以下离子中的若干种(忽略由水电离产生的H+、OH-):H+、NH4+、K+、Mg2+、Cu2+、Al3+、NO3-、CO32-、SO42-,现取三份100mL溶液进行如下实验:
①第一份加足量AgNO3溶液后,有白色沉淀产生。
②第二份加足量BaCl2溶液后,有白色沉淀产生,经洗涤、干燥后,沉淀质量为6.99 g。
③第三份逐滴滴加NaOH溶液,测得沉淀与NaOH溶液的体积关系如图。根据上述实验,以下推测不正确的是
| A.原溶液一定不存在H+、Cu2+、CO32- |
| B.不能确定原溶液是否含有K+、NO3- |
| C.原溶液确定含Mg2+、Al3+、NH4+,且n(Mg2+):n(Al3+):n( NH4+)=1:1:2 |
| D.实验所加的NaOH的浓度为2mol·L- |
在某无色溶液中缓慢地滴入NaOH溶液直至过量,产生沉淀的质量与加入的NaOH溶液体积的关系如右图所示,由此确定,原溶液中含有的阳离子是:( )
| A.H+、Mg2+、Al3+ | B.Mg2+、Al3+、Fe2+ |
| C.H+、Ba2+、Al3+ | D.只有Mg2+、Al3+ |
下列物质溶于水时会破坏水的电离平衡,且属于电解质的是( )
| A.氯气 | B.二氧化硫 | C.醋酸钠 | D.氯化钾 |
下列各组离子,一定能在指定环境中大量共存的是( )
| A.在含有大量I-的溶液中:Cl-、Fe3+、Al3+、Cu2+ |
| B.在由水电离出的c(H+)=10-12 mol·L-1的溶液中:Na+、Ba2+、Cl-、Br- |
| C.在使pH试纸变红的溶液中:Fe2+、Na+、SO42—、ClO- |
| D.在加入Al能放出大量H2的溶液中:NH4+、SO42—、Cl-、HCO3— |