题目内容
在给定的四种溶液中,含有以下各种微粒,一定能大量共存的是 ( )
| A.由水电离的c(OH-)=1×10-12mol/L的溶液中:Ba2+、K+、Br-、SiO32- |
| B.常温下葡萄糖溶液中:SCN—、Cl-、K+、NH4+ |
| C.溴水中:Na+、CO32-、NH4+、SO42— |
| D.PH大于7的溶液: Na+、Ba2+、SO32-、ClO— |
B
解析试题分析:A、在室温下纯水电离产生的c(OH-)=1×10-7mol/L.现在由水电离的c(OH-)=1×10-12mol/L说明溶液中存在大量的H+或OH-,对水的电离起到了抑制作用。若溶液显酸性,则发生反应2H++SiO32-=H2SiO3↓。离子不能电离共存。错误。B、常温下葡萄糖溶液中:SCN—、Cl-、K+、NH4+与葡萄糖分子不会发生任何反应,,可以大量共存。正确。C、溴水显酸性,这时会发生反应:2H++CO32-=H2O+CO2↑。不能大量共存。错误。D.发生沉淀反应Ba2++SO32-=BaSO3↓不能大量共存。错误。
考点:考查离子共存的知识。

练习册系列答案
 名题金卷系列答案
名题金卷系列答案
相关题目
25℃时,下列各溶液中,离子一定能大量共存的是( )
| A.在强碱性溶液中:Na+、K+、AlO2-、Cl- |
| B.pH=1的溶液中:HCO3-、NH4+、NO3-、Ca2+ |
| C.无色溶液中:Cu2+、NO3-、Cl-、H+ |
| D.无色溶液中: Na+、K+、ClO-、SO3 2- |
下列反应的离子方程式正确的是
| A.氯气与水反应:Cl2 + H2O = 2H+ + Cl-+ ClO- |
| B.硫化亚铁与稀硝酸反应:FeS + 2H+ = Fe2+ + H2S↑ |
| C.碳酸氢钠溶液与稀硫酸反应:HCO3- + H+ = H2O + CO2↑ |
| D.检验氯化亚铁溶液是否变质:Fe2++ 2SCN- = Fe(SCN)2 |
能用离子方程式H+ + OH- = H2O表示的是
| A.Ba(OH)2溶液和H2SO4溶液混合 |
| B.NaOH溶液和盐酸混合 |
| C.Cu(OH)2和稀H2SO4反应 |
| D.CO2通入NaOH溶液中 |
实验室欲配制一种仅含有四种离子(不考虑来源水电离的离子)的溶液,且溶液中四种离子的浓度均相等,能达到此目的的是
| A.Na+、Mg2+、SO42—、Cl— | B.ClO—、I—、NH4+、Ba2+ |
| C.Na+、AlO2—、K+、HCO3— | D.Al3+、K+、SO42—、NO3— |
下列离子方程式书写正确的是
| A.铵明矾[NH4Al(SO4)2·12H2O]溶液中加入过量Ba(OH)2溶液:Al3++2SO42-+2Ba2++4OH-=AlO2-+2BaSO4↓+2H2O |
| B.H218O中投入Na2O2固体:2H218O + 2Na2O2 = 4Na+ + 4OH- + 18O2↑ |
| C.碳酸氢钙溶液中加过量澄清石灰水:Ca2+ + OH- + HCO3- = CaCO3↓ + H2O |
D.碳酸钠的水解反应:CO32-+ H3O+ HCO3-+ H2O HCO3-+ H2O |
室温下,下列各组离子能大量共存的是
| A.稀硫酸中:K+、Mg2+、AlO2-、S2O32- |
| B.NaHS溶液中:SO42-、K+、Cl-、Cu2+ |
C.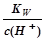 =10-13mol/L溶液中:Fe3+、NH4+、Mg2+、 SO42- =10-13mol/L溶液中:Fe3+、NH4+、Mg2+、 SO42- |
| D.通入大量CO2的溶液中:Na+、ClO-、CH3COO-、HCO3- |
下列解释实验现象的反应方程式正确的是 ( )
| A.切开的金属Na暴露在空气中,光亮表面逐渐变暗2Na+O2=Na2O2 |
| B.向AgCl悬浊液中滴加Na2S溶液,白色沉淀变成黑色2AgCl+S2-=Ag2S↓+2Cl- |
| C.Na2O2在潮湿的空气中放置一段时间,变成白色粘稠物2Na2O2+2CO2=2Na2CO3+O2 |
| D.向NaHCO3溶液中加入过量的澄清石灰水,出现白色沉淀2HCO3-+Ca2++2OH-=CaCO3↓+CO32-+2H2O |
一杯澄清透明的溶液中,已知各离子的浓度均为0.1 mol/L,体积为1 L。可能含有的离子:
阳离子:K+、Fe2+、Ba2+、NH4+ 阴离子:Cl-、NO3—、CO32—、SO42—
向该混合液中加足量稀盐酸,有无色气体生成,且阴离子的种类不变。对该溶液的下列叙述错误的是( )
| A.该溶液一定含有Fe2+、NO3—、Cl- | B.该溶液一定不含K+、NH4+ |
| C.该溶液一定不含CO32—、Ba2+ | D.该溶液可能含有SO42— |