题目内容
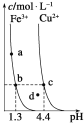
【题目】(I)短周期元素W、X、Y和Z在周期表中的相对位置如表所示,这四种元素原子的最外层电子数之和为21。回答下列问题:
W | X | |||
Y | Z |
(1)Z在元素周期表中的位置______________。
(2)X的最简单氢化物的电子式为______。
(3)Y单质与NaOH溶液反应的离子方程式为:________。工业生产Y单质的化学方程式为__________。
(4)向盛有3 mL鸡蛋清溶液的试管里滴入几滴W的最高价氧化物的水化物浓溶液,实验现象为_________。
(II)甲醇是重要的化工原料,又可作为燃料。利用合成气(主要成分为CO、CO2和H2)在催化剂的作用下合成甲醇,发生的主反应如下:
①CO(g)+2H2(g)![]() CH3OH(g)ΔH1
CH3OH(g)ΔH1
②CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)ΔH2
CH3OH(g)+H2O(g)ΔH2
③CO2(g)+H2(g)![]() CO(g)+H2O(g)ΔH3
CO(g)+H2O(g)ΔH3
回答下列问题:已知反应①中的相关的化学键键能数据如表:
化学键 | H—H | C—O |
(CO中的化学键) | H—O | C—H |
E/(kJ·mol-1) | 436 | 343 | 1076 | 465 | 413 |
(5)由此计算ΔH1=__kJ·mol-1,已知ΔH2=-58kJ·mol-1,则ΔH3=__kJ·mol-1。
【答案】第三周期 第VIIA族 ![]() 2Al+2OH-+2H2O=2AlO2-+3H2↑ 2Al2O3(熔融)
2Al+2OH-+2H2O=2AlO2-+3H2↑ 2Al2O3(熔融)![]() 4Al+3O2↑ 产生黄色沉淀(或淡黄色沉淀或变黄) -99 +41
4Al+3O2↑ 产生黄色沉淀(或淡黄色沉淀或变黄) -99 +41
【解析】
(I)根据元素在周期表中的位置和四种元素原子的最外层电子数之和为21可知,X为氧,Y为铝,Z为氯,W为氮;
(1)Z为氯元素,处于第三周期 第ⅦA族;
答案为:第三周期 第ⅦA族
(2)X为氧元素,最简单氢化物为水,电子式为![]() 。
。
答案为:![]()
(3)Y单质为铝,与NaOH溶液反应生成偏铝酸钠、氢气,离子方程式为:2Al+2OH-+2H2O=2AlO2-+3H2↑。工业生产铝单质的方法是电解氧化铝来制取,化学方程式为2Al2O3(熔融)![]() 4Al+3O2↑。
4Al+3O2↑。
答案为:2Al+2OH-+2H2O=2AlO2-+3H2↑;2Al2O3(熔融)![]() 4Al+3O2↑
4Al+3O2↑
(4)W为氮元素,最高价氧化物的水化物为硝酸,浓硝酸能使蛋白质变性,向盛有3 mL鸡蛋清溶液的试管里滴入几滴W的最高价氧化物的水化物浓溶液,实验现象为产生黄色沉淀(或淡黄色沉淀或变黄)。
答案为:产生黄色沉淀(或淡黄色沉淀或变黄);
(5)反应热=反应物总键能生成物总键能,故△H1=1076 kJ/mol +2×436 kJ/mol (3×413+343+465)kJ/mol=-99 kJ/mol;
根据盖斯定律:反应②-反应①=反应③,故△H3=△H2-△H1=-58 kJ/mol (-99 kJ/mol)=+41 kJ/mol,
故答案为:-99;+41;

 智趣寒假作业云南科技出版社系列答案
智趣寒假作业云南科技出版社系列答案【题目】硫酸工业中SO2转化为SO3是重要的反应之一,在一定压强和催化剂作用下在2L密闭容器中充入0.8molSO2和2molO2发生反应:2SO2(g)+O2(g)![]() 2SO3(g),SO2的转化率随温度的变化如下表所示:
2SO3(g),SO2的转化率随温度的变化如下表所示:
温度 | 450 | 500 | 550 | 600 |
SO2的转化率% | 97.5 | 95.8 | 90.50 | 80.0 |
(1)由表中数据判断△H________0(填“>”、“=”或“<”)。
(2)能判断该反应是否达到平衡状态的是___________。
A.容器的压强不变 B.混合气体的密度不变
C.混合气体中SO3的浓度不变 D. C(SO2)=C(SO3)
E.V正(SO2)=V正(SO3) F. V正(SO3)=2V逆(O2)
(3)某温度下经2min反应达到平衡后C(SO2)=0.08mol·L-1。
①0-2min之间,O2的反应速率为____。
②此时的温度为____℃。
③此温度下的平衡常数为_____(可用分数表示)。
(4)若将平衡反应混合物的压强增大(假如体积可变),平衡将_________向移动。
【题目】实验室用干燥而纯净的氯气和二氧化硫合成硫酰氯(SO2Cl2),原理为SO2+Cl2![]() SO2Cl2,装置如图所示(夹持仪器已省略):
SO2Cl2,装置如图所示(夹持仪器已省略):
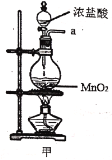
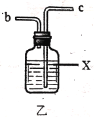
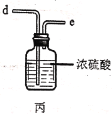
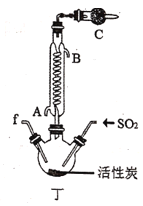
已知有关物质的部分性质如表:
物质 | 熔点/℃ | 沸点/℃ | 其他性质 |
SO2Cl2 | -54.1 | 69.1 | ①易与水反应,产生大量白雾 ②易分解:SO2Cl2 |
H2SO4 | 10.4 | 338 | 不易分解 |
请回答下列问题:
(1)写出甲中制取Cl2的化学方程式___。
(2)利用图中甲、乙、丙装置制取干燥纯净的Cl2,并在丁装置合成硫酰氯,要完成实验目的,按气流从左到右,各接口正确的连接顺序是___。
A.abcdef B.abcedf C.acbdef D.acbedf
乙中试剂X是___。
(3)丁中冷凝管进水口为___(填“A”或“B”)。装置C的作用是___。
(4)硫酰氯也可用氯磺酸(ClSO3H)分解获得,该反应的化学方程式为:2ClSO3H=H2SO4+SO2Cl2,此方法得到的产品中会混有硫酸。从分解产物中分离出硫酰氯的方法是___。
【题目】有五种短周期元素,它们的结构、性质等信息如下表所述:
元素 | 结构、性质等信息 |
A | 是短周期中(除稀有气体外)原子半径最大的元素,该元素的某种合金是原子反应堆的导热剂 |
B | B与A同周期,其最高价氧化物的水化物呈两性 |
C | 元素的气态氢化物极易溶于水,可用作制冷剂 |
D | 是海水中除氢、氧元素外含量最多的元素,其单质或化合物也是自来水生产过程中常用的消毒杀菌剂 |
E | L层上有2对成对电子 |
请根据表中信息填空:
(1)A原子的核外电子排布式为___________。
(2)B元素在周期表中的位置:__________________;离子半径:B___ A(填“大于”或“小于”)
(3)C原子的价电子排布图是___________,其原子核外有__________个未成对电子,能量最高的电子为___________轨道上的电子,其轨道呈___________形。
(4)D原子的电子排布式为___________。D-的结构示意图是________________
(5)C、E元素的第一电离能的大小关系是___________(用元素符号表示)。
(6)已知CD3分子中D元素为+1价,则C、D的电负性大小关系是________________(用元素符号表示),CD3与水反应后的产物是__________和__________。