题目内容
【题目】研究发现,NOx和SO2是雾霾的主要成分。
Ⅰ. NOx主要来源于汽车尾气,可以利用化学方法将二者转化为无毒无害的物质。
已知:N2(g)+O2(g) ![]() 2NO(g) ΔH=+180 kJ·mol-1
2NO(g) ΔH=+180 kJ·mol-1
2CO(g)+O2(g) ![]() 2CO2(g) ΔH=-564 kJ·mol-1
2CO2(g) ΔH=-564 kJ·mol-1
(1)2NO(g)+2CO(g)![]() 2CO2(g)+N2(g) ΔH=________.
2CO2(g)+N2(g) ΔH=________.
(2)T℃时,将等物质的量的NO和CO充入容积为2 L的密闭容器中,保持温度和体积不变,反应过程(0~15 min)中NO的物质的量随时间变化如图所示。

①已知:平衡时气体的分压=气体的体积分数×体系的总压强,T℃时达到平衡,此时体系的总压强为p=20MPa,则T℃时该反应的压力平衡常数Kp =_______;平衡后,若保持温度不变,再向容器中充入NO和CO2各0.3mol,平衡将_____ (填“向左”、“向右”或“不”)移动。
②15 min时,若改变外界反应条件,导致n(NO)发生如上图所示的变化,则改变的条件可能是_____(填序号)
A.增大CO浓度 B.升温 C.减小容器体积 D.加入催化剂
Ⅱ. SO2主要来源于煤的燃烧。燃烧烟气的脱硫减排是减少大气中含硫化合物污染的关键。
已知:亚硫酸:Ka1=2.0×10-2 Ka2=6.0×10-7
(3)请通过计算证明,NaHSO3溶液显酸性的原因:_________________________
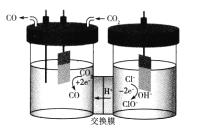
(4)如图示的电解装置,可将雾霾中的NO、SO2转化为硫酸铵,从而实现废气的回收再利用。通入NO的电极反应式为____________________;若通入的NO体积为4.48L(标况下),则另外一个电极通入的SO2质量至少为________g。

【答案】 -744 kJ·mol-1 0.0875 (或7/80) 不 AC HSO3-的水解常数K=Kw/Ka1=5.0×10-13<Ka2=6.0×10-7(HSO3-的电离常数),所以显酸性 6H++ NO+ 5e- = NH![]() +H2O 32
+H2O 32
【解析】
本题考查盖斯定律、化学平衡常数计算、勒夏特列原理、电离平衡常数、水解平衡常数、水的离子积的关系等。
(1)由盖斯定律可知:①N2(g)+O2(g) ![]() 2NO(g),②2CO(g)+O2(g)
2NO(g),②2CO(g)+O2(g) ![]() 2CO2(g),②-①得出:△H=(-564-180)kJ·mol-1=-744kJ·mol-1;
2CO2(g),②-①得出:△H=(-564-180)kJ·mol-1=-744kJ·mol-1;
(2) ①2NO(g)+2CO(g)![]() 2CO2(g)+N2(g)
2CO2(g)+N2(g)
起始/mol: 0.4 0.4 0 0
变化/mol: 0.2 0.2 0.2 0.1
平衡/mol: 0.2 0.2 0.2 0.1,
p(NO)=p(CO)=p(CO2)= 20MPa×![]() =
=![]()
p(N2)= 20MPa×![]() =
=![]()
Kp=![]() =
=![]() =0.0875;根据①的分析,化学平衡常数K=5,再向容器中充入NO和CO2各0.3mol,此时的浓度商为仍为5,因此平衡不移动;②15min时,改变某一因素,NO的物质的量减少,说明平衡向正反应方向移动。增大CO的浓度,平衡向正反应方向移动,NO的物质的量减小,A项正确;正反应是放热反应,升温,平衡向逆反应方向移动,NO的物质的量增大,B项错误;减小容器的体积,相当于增大压强,平衡向正反应方向移动,NO物质的量减小,C项正确;加入催化剂,化学平衡不移动,D项错误;(3)HSO3-的水解常数K=Kw/Ka1=5.0×10-13<Ka2=6.0×10-7,电离平衡常数大于水解
=0.0875;根据①的分析,化学平衡常数K=5,再向容器中充入NO和CO2各0.3mol,此时的浓度商为仍为5,因此平衡不移动;②15min时,改变某一因素,NO的物质的量减少,说明平衡向正反应方向移动。增大CO的浓度,平衡向正反应方向移动,NO的物质的量减小,A项正确;正反应是放热反应,升温,平衡向逆反应方向移动,NO的物质的量增大,B项错误;减小容器的体积,相当于增大压强,平衡向正反应方向移动,NO物质的量减小,C项正确;加入催化剂,化学平衡不移动,D项错误;(3)HSO3-的水解常数K=Kw/Ka1=5.0×10-13<Ka2=6.0×10-7,电离平衡常数大于水解
平衡常数,说明溶液显酸性;(4)根据电解装置,NO和SO2转化为硫酸铵,说明NO转化成NH4+,即NO在阴极上发生NO+6H++5e-=NH4++H2O;阳极反应式为SO2+2H2O-2e-=4H++SO42-,根据得失电子数目守恒,因此有2NO~10e-~5SO2,求出SO2的质量为4.48×5×64/(2×22.4)g=32g。

【题目】下列指定反应的化学用语表达正确的是( )
A | Mg(HCO3)2溶液与足量的NaOH溶液反应 | Mg2++2HCO |
B | 过量SO2通入到NaClO溶液中: | SO2+H2O+ClO-===HClO+ |
C | 向Al2(SO4)3溶液中加入过量的稀氨水 | Al3 ++4NH3·H2O=AlO2—+4NH4++2H2O |
D | KClO碱性溶液与Fe(OH)3反应制取K2FeO4 | 3ClO﹣+2Fe(OH)3=2FeO42﹣+3Cl﹣+4H++H2O |
A. AB. BC. CD. D