题目内容
2.高铁酸钾(K2FeO4)是一种新型、高效、多功能绿色水处理剂,比Cl2、O2、ClO2、KMnO4氧化性更强,无二次污染,工业上是先制得高铁酸钠,然后在低温下,向高铁酸钠溶液中加入KOH至饱和,使高铁酸钾析出.(1)干法制备高铁酸钾的主要反应为2FeSO4+6Na2O2═2Na2FeO4+2Na2O+2Na2SO4+O2↑.该反应中的氧化剂是Na2O2,还原剂是FeSO4和Na2O2,每生成1mol Na2FeO4转移5mol电子.
(2)湿法制备高铁酸钾(K2FeO4)的反应体系中有六种微粒:Fe(OH)3、ClO-、OH-、FeO${\;}_{4}^{2-}$、Cl-、H2O.
①写出并配平湿法制高铁酸钾的离子反应方程式:2Fe(OH)3+3ClO-+4OH-═2FeO42-+3Cl-+5H2O
②每生成1molFeO${\;}_{4}^{2-}$转移3mol电子,若反应过程中转移了0.3mol电子,则还原产物的物质的量为0.15mol.
分析 (1)2FeSO4+6Na2O2═2NaFeO4+2Na2O+2Na2SO4+O2↑中Fe、O元素的化合价升高,O元素的化合价降低,由化合价的变化计算转移的电子数;
(2)①湿法制备高铁酸钾(K2FeO4)时,Fe(OH)3失电子被氧化生成K2FeO4,则C1O-作氧化剂被还原生成C1-,氢氧化铁必须在碱性条件下存在,所以该反应是在碱性条件下进行,再结合转移电子守恒配平方程式;
②根据化合价变化和电子转移情况来计算.
解答 解:(1)反应中Fe颜色化合价由+2价升高为+6价,被氧化,FeSO4为还原剂,过氧化钠中O元素的化合价由-1价降低为-2价,由-1价升高为0,过氧化钠既是氧化剂也是还原剂,由方程式可知,生成2molNa2FeO4,有6molNa2O2参加反应,转移10mol电子,则每生成1molNa2FeO4转移的电子数为5mol,
故答案为:Na2O2;FeSO4和Na2O2;5;
(2)①湿法制备高铁酸钾(K2FeO4)时,Fe(OH)3失电子被氧化生成K2FeO4,Fe的化合价升高了3价,C1O-作氧化剂被还原生成C1-,氯元素的价态降了2价,根据电子守恒,得到铁元素物质前边系数是2,Cl的前边系数是3,氢氧化铁必须在碱性条件下存在,所以该反应是在碱性条件下进行,该离子反应为2Fe(OH)3+3ClO-+4OH-═2FeO42-+3Cl-+5H2O,
故答案为:2Fe(OH)3+3ClO-+4OH-═2FeO42-+3Cl-+5H2O;
②反应2Fe(OH)3+3ClO-+4OH-═2FeO42-+3Cl-+5H2O中转移电子是6mol,生成2mol2FeO42-,每生成1mol2FeO42-转移3mol电子,若反应过程中转移了0.3mol电子,则还原产物氯离子的物质的量为0.15mol,故答案为:3;0.15.
点评 本题考查氧化还原反应的计算,为高频考点,把握反应中元素的化合价变化、转移电子计算等为解答的关键,侧重分析与计算能力的考查,题目难度不大.

| A. | ${\;}_{55}^{\;}$Br的电子排布式可简写为[Ar]4s24p5 | |
| B. | 16O与18O互为同位素,H216O、H218O互为同素异形体 | |
| C. | CH4、NH${\;}_{4}^{+}$粒子的空间构型均为正四面体形 | |
| D. | NH4Cl的电子式为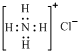 |
| A. | 医用酒精的浓度通常为75% | |
| B. | 单质硅是光导纤维的主要材料 | |
| C. | 淀粉、纤维素和油脂都属于天然高分子化合物 | |
| D. | 合成纤维和光导纤维都是新型无机非金属材料 |
| A. | 用铜做电极电解CuSO4溶液:2Cu2++2H2O═2Cu+O2↑+4H+ | |
| B. | NaClO溶液与FeCl2溶液混合:Fe2++2ClO-+2H2O═Fe(OH)2↓+2HClO | |
| C. | NH4HSO3溶液与足量NaOH溶液共热:NH${\;}_{4}^{+}$+H++2OH-═NH3↑+2H2O | |
| D. | 向FeCl3溶液中加入Mg(OH)2:3Mg(OH)2+2Fe3+═2Fe(OH)3+3Mg2+ |
| A. | 硅是良好的半导体材料高温 | |
| B. | 二氧化硅能与石灰石反应:SiO2+CaCO3$\frac{\underline{\;高温\;}}{\;}$CaSiO3+CO2↑ | |
| C. | 可以用焦炭还原二氧化硅生产硅:SiO2+2C $\frac{\underline{\;高温\;}}{\;}$Si+2CO↑ | |
| D. | 光纤通信的光导纤维是由硅晶体经特殊工艺制成的 |
 .
. .
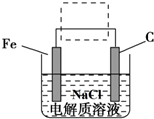
. 、Fe+2H2O$\frac{\underline{\;通电\;}}{\;}$Fe(OH)2(胶体)+H2↑
、Fe+2H2O$\frac{\underline{\;通电\;}}{\;}$Fe(OH)2(胶体)+H2↑