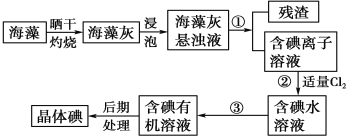
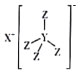题目内容
【题目】图为某同学设计的原电池装置
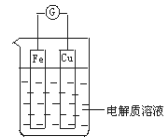
(1)当电解质溶液为稀硫酸时:
①Fe电极是_______(填“正”或“负”)极,其电极反应为_______
②Cu电极的电极反应为_________,该电极发生______反应(填“氧化”或“还原”)反应。原电池工作一段时间后,铁片的质量减少了2.8克,铜片表面产生气体____L(标准状况下),导线中通过_____mol电子。
(2)当电解质溶液为稀硝酸时:
①Fe电极是______极,其电极反应为________________,
②Cu电极是_____极,其电极反应为_________________,
【答案】负 Fe-2e-=Fe2+ 2H++2e-=H2↑ 还原 1.12L 0.1 负 Fe-2e-=Fe2+ 正 NO![]() +4H++3e-=NO↑+2H2O
+4H++3e-=NO↑+2H2O
【解析】
(1)①当电解质溶液为稀硫酸时电池总反应为Fe+H2SO4= H2↑+FeSO4,所以铁电极发生氧化反应为负极,电极反应式为Fe-2e-=Fe2+;
②铜电极上氢离子得电子生成氢气,电极反应式为2H++2e-=H2↑,发生还原反应;铁片减少2.8g,物质的量为![]() =0.05mol,根据电极反应式可知转移电子为0.1mol,生成氢气的物质的量为0.05mol,标况下的体积为0.05mol×22.4L/mol=1.12L;
=0.05mol,根据电极反应式可知转移电子为0.1mol,生成氢气的物质的量为0.05mol,标况下的体积为0.05mol×22.4L/mol=1.12L;
(2)①当电解质溶液为稀硝酸时,由于Fe比Cu活泼,所以电池总反应为3Fe+8HNO3=3Fe(NO3)2+2NO↑+4H2O;所以Fe电极为负极,电极反应式为Fe-2e-=Fe2+;
②Cu电极上硝酸根得电子发生还原反应,所以Cu为正极,电极反应式为NO![]() +4H++3e-=NO↑+2H2O。
+4H++3e-=NO↑+2H2O。

练习册系列答案
 口算题天天练系列答案
口算题天天练系列答案
相关题目