题目内容
【题目】氢气是一种清洁能源,氢气的制取与储存是氢能源利用领域的研究热点。
(1)在700℃时,向容积为2L的密闭容器中充入一定量的CO和H2O,发生反应:CO(g)+H2O(g)![]() CO2(g)+H2(g),反应过程中测定的部分数据见下表(表中t2 > t1):
CO2(g)+H2(g),反应过程中测定的部分数据见下表(表中t2 > t1):
反应时间/min | 0 | t1 | t2 |
n(CO)/mol | 1.20 | 0.80 | 0.80 |
①反应在t1min内的平均速率:v(H2)=____mol·L-1·min-1。
②t2时刻,该反应的正反应速率___逆反应速率(填“大于”、“小于”或“等于”)。
(2)氢氧燃料电池可以使用在航天飞机上,其反应原理示意图如图。
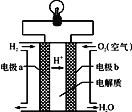
①该电池供电时,____能转化为____能。
②写出该电池供电时的总反应方程式________。
③电极b上发生______反应(“氧化”或“还原”)。
④在外电路中,电子流动的方向为________。
(3)镁铝合金(Mg17Al10)是一种潜在的贮氢材料,可在氩气保护下,将一定化学计量比的Mg、Al单质在一定温度下熔炼获得。该合金在一定条件下完全吸氢的反应方程式为Mg17Al10+17H2=17MgH2+10Al。得到的混合物Y(17MgH2+10Al)在一定条件下可释放出氢气。
①镁铝合金的熔点比金属镁的熔点______。(填“高”或“低”)
②在6.0 mol·L-1 HCl溶液中,混合物Y能完全释放出H2。1 mol Mg17Al10完全吸氢后得到的混合物Y与足量上述盐酸完全反应,释放出H2的物质的量为______。
【答案】0.2/t1 等于 化学 电 2H2+O2=2H2O 还原 由a到b 低 49
【解析】
(1)①根据表格数据首先计算v(CO),再根据速率之比=化学计量数之比计算v(H2);②反应在t2时刻为平衡状态;
(2)氢氧燃料电池中,氢气易失电子发生氧化反应,所以通入氢气的电极a是负极,氧气易得电子发生还原反应,所以通入氧气的电极b是正极,电流由正极电极b通过导线流向负极电极a,据此分析解答;
(3)①合金的熔点比成分金属的熔点低;②释放出的H2 包括Mg17Al12吸收的氢,还包括镁、铝和盐酸反应生成的氢气。
(1)①根据表格数据,反应在t1min时达到平衡状态,v(CO)= =
=![]() mol·L-1·min-1,则v(H2)=v(CO)=
mol·L-1·min-1,则v(H2)=v(CO)=![]() mol·L-1·min-1,故答案为:
mol·L-1·min-1,故答案为:![]() ;
;
②根据表格数据t2时刻为平衡状态,反应的正反应速率等于逆反应速率,故答案为:等于;
(2)①燃料电池中,将化学能转化为电能,故答案为:化学;电;
②氢氧燃料电池的总反应式为2H2+O2═2H2O,故答案为:2H2+O2═2H2O;
③氢氧燃料电池中通入氧气的电极b是正极,发生还原反应,故答案为:还原;
④在原电池中电子从负极沿导线流向正极,a是负极、b是正极,则电子由电极a通过导线流向电极b,故答案为:由a到b;
(3)①合金的熔点比成分金属的熔点低,因此镁铝合金的熔点比金属镁的熔点低,故答案为:低;
②根据反应的方程式,1molMg17Al10完全吸氢17mol,在盐酸中会全部释放出来,镁铝合金中的镁和铝都能与盐酸反应生成H2,生成氢气的物质的量分别为17mol、10×![]() =15mol,则生成氢气一共(17+17+15)mol=49mol,故答案为:49mol。
=15mol,则生成氢气一共(17+17+15)mol=49mol,故答案为:49mol。