题目内容
【题目】钛酸钡(BaTiO3)在工业上有重要用途,主要用于制作电子陶瓷、PTC热敏电阻、电容器等多种电子元件。以下是生产钛酸钡的一种工艺流程图:
![]()
已知:①草酸氧化钛钡晶体的化学式为BaTiO(C2O4)2·4H2O;
(1)BaTiO3中Ti元素的化合价为:__________。
(2)用盐酸酸浸时发生反应的离子方程式为: ________________________________。
(3)流程中通过过滤得到草酸氧化钛钡晶体后,为提高产品质量需对晶体洗涤。
①过滤操作中使用的玻璃仪器有__________________________________________。
②如何证明晶体已洗净?_________________________________________。
(4)某兴趣小组取19.70gBaCO3模拟上述工艺流程制备BaTiO3,得产品13.98g,BaTiO3的产率为:________。
【答案】+4 BaCO3 + 2H+ = Ba2+ + CO2 ↑+ H2O漏斗、 烧杯、 玻璃棒取最后一次洗涤液少许于试管中, 滴加稀 HNO3 酸化的 AgNO3 溶液, 若无白色沉淀产生, 说明已洗净60%
【解析】
碳酸钡与盐酸反应生成氯化钡,然后氯化钡与四氯化碳、草酸反应生成BaTiO(C2O4)2·4H2O,同时得到为HCl,HCl再循环利用,经过过滤、洗涤、干燥、煅烧得到BaTiO3.
(1)由化合价代数和等于0,BaTiO3中Ti元素的化合价为x:2+x-3×2=0,x=+4;(2)用盐酸酸浸时碳酸钡和盐酸反应生成氯化钡、二氧化碳和水,发生反应的离子方程式为:BaCO3 + 2H+ = Ba2+ + CO2 ↑+ H2O ;(3)①过滤操作中使用的玻璃仪器有漏斗、烧杯、玻璃棒;②证明晶体已洗净:取最后一次洗涤液少许于试管中,滴加稀HNO3 酸化的 AgNO3 溶液,若无白色沉淀产生,说明已洗净。(4)先算出理论产量: BaTiO3 摩尔质量 233.192 g·mol-1 ,m(BaTiO3)= 233.192 g·mol-1×19.70g/197 g·mol-1=23.32g,得产品13.98g,BaTiO3的产率为:13.98g/23.32g×100%=60%.

 步步高达标卷系列答案
步步高达标卷系列答案【题目】氢气是一种清洁能源,氢气的制取与储存是氢能源利用领域的研究热点。
(1)在700℃时,向容积为2L的密闭容器中充入一定量的CO和H2O,发生反应:CO(g)+H2O(g)![]() CO2(g)+H2(g),反应过程中测定的部分数据见下表(表中t2 > t1):
CO2(g)+H2(g),反应过程中测定的部分数据见下表(表中t2 > t1):
反应时间/min | 0 | t1 | t2 |
n(CO)/mol | 1.20 | 0.80 | 0.80 |
①反应在t1min内的平均速率:v(H2)=____mol·L-1·min-1。
②t2时刻,该反应的正反应速率___逆反应速率(填“大于”、“小于”或“等于”)。
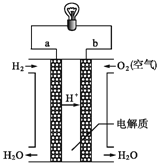
(2)氢氧燃料电池可以使用在航天飞机上,其反应原理示意图如图。
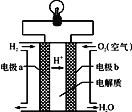
①该电池供电时,____能转化为____能。
②写出该电池供电时的总反应方程式________。
③电极b上发生______反应(“氧化”或“还原”)。
④在外电路中,电子流动的方向为________。
(3)镁铝合金(Mg17Al10)是一种潜在的贮氢材料,可在氩气保护下,将一定化学计量比的Mg、Al单质在一定温度下熔炼获得。该合金在一定条件下完全吸氢的反应方程式为Mg17Al10+17H2=17MgH2+10Al。得到的混合物Y(17MgH2+10Al)在一定条件下可释放出氢气。
①镁铝合金的熔点比金属镁的熔点______。(填“高”或“低”)
②在6.0 mol·L-1 HCl溶液中,混合物Y能完全释放出H2。1 mol Mg17Al10完全吸氢后得到的混合物Y与足量上述盐酸完全反应,释放出H2的物质的量为______。