题目内容
【题目】氢气是清洁的能源,也是重要的化工原料,根据以下两种制氢方法,完成下列问题:

(1)方法一:H2S热分解法,反应式为:H2S (g) ![]() H2 (g)+S(g) △H,在恒容密闭容器中,测定H2S分解的转化率(H2S的起始浓度均为c mol/L),测定结果见图1,其中曲线a表示H2S的平衡转化率与温度关系,曲线b表示不同温度下反应经过相同时间未达到化学平衡时H2S的转化率。
H2 (g)+S(g) △H,在恒容密闭容器中,测定H2S分解的转化率(H2S的起始浓度均为c mol/L),测定结果见图1,其中曲线a表示H2S的平衡转化率与温度关系,曲线b表示不同温度下反应经过相同时间未达到化学平衡时H2S的转化率。
①△H___________0(填“>”“<”或“=”)。
②若985℃时,反应经t min达到平衡,此时H2S的转化率为40%,则tmin内反应速率v(H2)=______(用含c、t的代数式表示)。
③请说明随温度的升高,曲线b向曲线a接近的原因:_________________。
(2)方法二:以CaO为吸收体,将生物材质(以C计)与水蒸气反应制取H2。相关主要反应如下:
I.C(s) + H2O (g) = CO (g) + H2(g) △H = + 131.6 kJ/mol
II.CO (g) + H2O (g) = CO2 (g) + H2 (g) △H = -43 kJ/mol
III.CaO(s) + CO2(g) = CaCO3(s) △H = -178.3 kJ/mol
①计算反应C (s) +2H2O(g) +CaO(s) ==CaCO3 (s)+2H2 (g)的△H=_____(保留到小数点后面1位);若K1、K2、K3分别为反应I、II、III的平衡常数,该反应的平衡常数k=______(用K1、K2、K3表示)。
②对于可逆反应C (s) +2H2O(g) +CaO(s) ![]() CaCO3 (s)+2H2 (g),采取以下措施可以提高H2产率的是___。 (填字母编号)
CaCO3 (s)+2H2 (g),采取以下措施可以提高H2产率的是___。 (填字母编号)
A.适当的降低体系的温度 B.使各气体组分浓度均加倍
C.用特殊材料吸收氢气 D.增加CaO的量
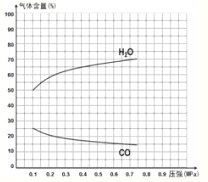
③图2为反应I在一定温度下,平衡时各气体体积百分含量随压强变化的关系图。若反应达某一平衡状态时,测得c( H2O)=2c(H2)= 2c(CO)=2 mol/L,试根据H2O的体积百分含量变化曲线,补充完整CO的变化曲线示意图。___________________
(3)以N2、H2为电极反应物,以HCl-NH4C1为电解质溶液制造新型燃料电池,放电过程中,溶液中NH4+浓度逐渐增大,写出该电池的正极反应式:___________________。
【答案】 > 0.4/c 温度升高,反应速率加快,达到平衡所需时间缩短 -89.7kJ/mol K1·K2·K3 AC 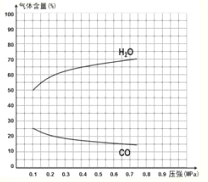 N2+6e-+8H+= 2NH4+
N2+6e-+8H+= 2NH4+
【解析】(1)①由图象可知,温度升高,转化率增大,则平衡正移,所以正方向为吸热方向,即△H>0,故答案为:>;
②H2S的起始浓度均为c mol·L-1,若985℃时,反应经t min达到平衡,此时H2S的转化率为40%,则参加反应的硫化氢为c mol·L-1×40%=0.4cmol·L-1,
v=△c/t=0.4c/tmol·L-1·min-1;故答案为:0.4c/tmol·L-1·min-1
③随着温度升高,反应速率逐渐加快,达到平衡所需时间缩短,所以曲线b向曲线a逼近;故答案为:温度升高,反应速率加快,达到平衡所需时间缩短;
(2)①已知:I:C(s)+H2O(g)═CO(g)+H2(g)△H = + 131.6 kJ/mol K1
Ⅱ:CO(g)+H2O(g)═CO2(g)+H2(g) △H = -43 kJ/mol K2
Ⅲ:CaO(s)+CO2(g)═CaCO3(s)△H = -178.3 kJ/mol K3
反应I、II、III之和为反应C(s)+2H2O(g)+CaO(s)═CaCO3(s)+2H2(g),△H =+ 131.6 kJ/mol -43 kJ/mol -178.3 kJ/mol = -89.7kJ/mol ,则K=K1·K2·K3 ;故答案为: -89.7kJ/mol 、K1·K2·K3 ;
②提高H2产量,则需使平衡正向移动,已知C(s)+2H2O(g)+CaO(s)![]() CaCO3(s)+2H2(g),△H=-87.9kJ·mol-1;
CaCO3(s)+2H2(g),△H=-87.9kJ·mol-1;
A.该反应为放热反应,降低体系的温度,平衡正移,则能提高H2产量,故A正确;
B.该反应前后气体体积不变,使各气体组分浓度均加倍,则压强增大,平衡不移动,所以H2产量不变,故B错误;
C.用特殊材料吸收氢气,平衡正移,则能提高H2产量,故C正确;
D.增加CaO的量,对平衡无影响,所以H2产量不变,故D错误;
故答案为:AC;
③反应中H2O的变化量约等于CO的变化量,当起始水的含量为50%,则H2、CO各占25%,则CO的曲线的起点坐标为(0.1,25),平衡时水的含量为70%,则H2、CO各占15%,H2O含量变化与CO含量变化关于含量y=37.5的直线对称,故图中CO的变化曲线示意图为:
(3)以N2、H2为原料,以HCl-NH4Cl为电解质溶液构成新型燃料电池,正极发生还原反应,即氮气被还原生成NH4+,电极反应式为N2+6e-+8H+=2NH4+;负极是氢气失电子生成氢离子,电极方程式为H2-2e-=2H+。故答案为:N2+6e-+8H+=2NH4+。

 阅读快车系列答案
阅读快车系列答案【题目】元素①~⑩在周期表中的位置如表所示,试回答下列问题。
周期 族 | IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 |
2 | ① | ② | ③ | |||||
3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
4 | ⑨ | ⑩ |
(1)上述10种元素中,化学性质最不活泼的是_______(填元素符号,下同) ;与水反应最激烈的金属元素是_______。
(2)元素②的气态氢化物的分子式是_______;上述10种元素中,其最高价氧化物对应水化物的酸性最强的物质是_____(填化学式)。
(3)用电子式表示元素③与④形成1:2型化合物的形成过程_______。
(4)①②⑤元素的原子半径由小到大的顺序为_______(用元素符号表示) ③⑦⑩元素的气态氢化物的稳定性由强到弱的顺序为_______(用氢化物的化学式表示)。
(5)④和⑥两元素的最高价氧化物对应的水化物相互反应的离子方程式:______。
【题目】室温下,将0.05mol Na2CO3固体溶于水配成100mL溶液,向溶液中加入下列物质,有关结论正确的是
加入的物质 | 结论 | |
A | 50 mL 1 mol·L-1H2SO4 | 反应结束后,c(Na+)=c(SO42-) |
|
| 溶液中 |
C | 50 mL H2O | 由水电离出的c(H+)·c(OH-)不变 |
D | 0.1 mol NaHSO4固体 | 反应完全后,溶液pH减小,c(Na+)不变 |
A. A B. B C. C D. D