��Ŀ����
����Ŀ���о����֣�һ�ڵ�����ڵ���ܹ�ʹһƽ��������ʧȥ���ü�ֵ���Ͼɵ�ص�Σ����Ҫ���������������������ؽ����ϡ����Ͼ�п�̵�ػ��մ��������ܼ������Ի�������Ⱦ������ʵ�ַϵ�ص���Դ�����á�
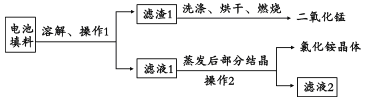
��1�����������еĶ������̺��Ȼ�李���֪���Ͼɸɵ�����ϵ���Ҫ�ɷ�Ϊ�������̡�̿�ۡ��Ȼ�狀��Ȼ�п�ȣ������Ȼ�李��Ȼ�п������ˮ���������ʵ�������ͼ��ʾ��
�� �������Ƚ�������������Ŀ���ǣ�________________��
�� ����l�Ͳ���2�����ƶ���___________���ò����в�������������___________��
�� ��������l��Ŀ����______________________��
��2�����ն��Ȼ��̣����Ͼ�п�̵�ش������õ����̻�����û�������Ũ���Ტ���ȡ�
��д��MnOOH��Ũ���ᷴӦ�Ļ�ѧ����ʽ��________________��
�� �̻����·�������Ͼ�п�̵���ڵĻ����[��Ҫ�ɷ�MnOOH��Zn(OH)2]�м���һ������ϡ�����ϡ���ᣨH2C2O4���������Ͻ�������CO2����Ϊֹ��д��MnOOH���뷴Ӧ�Ļ�ѧ����ʽ______________����ʹ��Ũ�����������ȣ��·������ŵ���___________����l�㼴�ɣ���
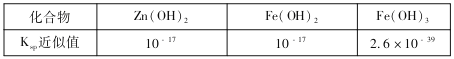
��3���÷ϵ�ص�пƤ�����ڻ�������ZnSO4��7H2O�������У����ȥпƤ�е��������������䷽���ǣ������£�����ϡH2SO4��H2O2�����ܽ��ΪFe3+���Ӽ����pHΪ4��ʹ��Һ�е�Fe3+ת��ΪFe(OH)3��������ʱ��Һ��c(Fe3+)=_________�������Ӽ����pHΪ____ʱ��п��ʼ�������ٶ�Zn2+Ũ��Ϊ0.1mol/L�����������ܵĵ�����ܶȻ�������Ksp�����±���
���𰸡� ����Ӵ�������ӿ췴Ӧ���� ���� ���� ��ȥ̿�� 2MnOOH+6HCl=2MnCl2+Cl2��+4H2O ��2MnOOH+H2C2O4+2H2SO4=2MnSO4+2CO2��+4H2O �����̼�����CO2��H2O��Ӱ��MnSO4���ȣ���Ӧ�������ж��к��������ɣ�����ɶ�����Ⱦ��������Դ���ȣ���1�㼴�ɣ� 2.6��10-9 6
����������������������ԷϾɵ�ص�������Ϊ���忼�黯ѧʵ�������������ѧ����ʽ����д�ͳ����ܽ�ƽ����ؼ��㡣��Ŀ�Ѷ��еȡ������Ҫע����ϵ��ѧʵ��������������ϼ���������ƽ�ͳ����ܽ�ƽ�����֪ʶ��������
�����1�����������еĶ������̺��Ȼ�李��Ͼɸɵ�����ϵ���Ҫ�ɷ�Ϊ�������̡�̿�ۡ��Ȼ�狀��Ȼ�п�ȣ������Ȼ�李��Ȼ�п������ˮ��̿�ۺͶ������̲�����ˮ������������ܽ⡢���ˣ�����1Ϊ̿�ۺͶ������̵Ļ�����ϴ�ӡ���ɡ�ȼ�գ�̿����������Ӧ���ɶ�����̼��ʣ��Ĺ���Ϊ�������̣���Һ1Ϊ�Ȼ�狀��Ȼ�п�Ļ��Һ�������ᾧ�����˵��Ȼ�茶��塣
�� �������Ƚ�������������Ŀ��������Ӵ�������ӿ췴Ӧ���ʡ�
�� ����l�Ͳ���2Ϊ��������Һ������IJ����������ǹ��ˣ���������������������
�� ��������l��Ŀ���dz�ȥ̿�ۡ�
��2����MnOOH��Ũ���ᷴӦ���ɶ��Ȼ��̡�������ˮ�����û��ϼ���������ƽ���÷�Ӧ����ѧ����ʽΪ2MnOOH+6HCl=2MnCl2+Cl2��+4H2O��
��MnOOH��ϡ�����ϡ���ᣨH2C2O4����Ӧ���������̡�������̼��ˮ�����û��ϼ���������ƽ���÷�Ӧ�Ļ�ѧ����ʽΪ2MnOOH+H2C2O4+2H2SO4=2MnSO4+2CO2��+4H2O ����ʹ��Ũ�����������ȣ��·������ŵ����������̼�����CO2��H2O��Ӱ��MnSO4���ȣ���Ӧ�������ж��к��������ɣ�����ɶ�����Ⱦ��������Դ���ȡ�
��3����Һ��pHΪ4��c(OH-)=1��10-10mol/L����Ksp[Fe(OH)3]=c(Fe3+)c3(OH-)=2.6��10-39����ʱ��Һ��c(Fe3+)= 2.6��10-9mol/L��Ksp[Zn(OH)2]=c(Zn2+)c2(OH-)=10-17����Zn2+Ũ��Ϊ0.1mol/L����c(OH-)=10-8mol/L��c(H+)=10-6mol/L��pH=6��




