题目内容
7.根据要求完成下列问题:(1)某元素原子共有3个价电子,其中一个价电子位于第三能层d轨道,试回答:
该元素核外价电子排布图
 .该元素的原子序数为21,该元素是金属元素(填“金属”或“非金属”),形成的单质为金属晶体.
.该元素的原子序数为21,该元素是金属元素(填“金属”或“非金属”),形成的单质为金属晶体.(2)指出配合物K3[Co(CN)6]中的中心离子、配位体及其配位数:Co3+、CN-、6.
(3)在下列物质①CO2、②NH3、③CCl4、④BF3、⑤H2O、⑥SO2、⑦SO3、⑧、PCl3中,属于非极性分子的是(填番号)①③④⑦.
(4)试比较下列含氧酸的酸性强弱(填“>”、“<”或“=”):HClO3<HClO4; H3PO4>H3PO3.
(5)根据价层电子对互斥理论判断下列问题:
①NH3中心原子的杂化方式为sp3杂化,VSEPR构型为正四面体,
②BF3分子中,中心原子的杂化方式为sp2杂化,分子的立体构型为平面三角形.
(6)H2O的沸点(100℃)比H2S的沸点(-61℃)高,这是由于水分子之间可形成氢键.
分析 (1)某元素原子共有3个价电子,其中一个价电子位于第三能层d轨道,价电子排布式为3d14s2,其基态原子核外电子排布式为:1s22s22p63s23p63d14s2,处于第四周期ⅢB族,为金属元素;
(2)根据配合物理论分析,配位体:提供孤电子对的分子或离子;配位原子:配体中,提供电子对的原子,配位数:中心原子周围的配位原子个数;
(3)不同非金属元素之间易形成极性键,正负电荷重心重合的分子为非极性分子;
(4)同一元素的含氧酸,该元素的化合价越高,对应的含氧酸的酸性越强;
(5)①N原子价层电子对个数=σ键个数+孤电子对个数,据此分析解答;②B原子价层电子对个数=σ键个数+孤电子对个数;
(6)根据氢键进行分析,氢键影响晶体的熔沸点.
解答 解:(1)某元素原子共有3个价电子,其中一个价电子位于第三能层d轨道,价电子排布式为3d14s2,其价电子排布图为: ,其基态原子核外电子排布式为:1s22s22p63s23p63d14s2,原子序数为21,处于第四周期ⅢB族,属于金属元素,形成金属晶体,
,其基态原子核外电子排布式为:1s22s22p63s23p63d14s2,原子序数为21,处于第四周期ⅢB族,属于金属元素,形成金属晶体,
故答案为: ;21;金属;金属;
;21;金属;金属;
(2)配合物K3[Co(CN)6]中的中心离子为Co3+、配位体是CN-、配位数为6;
故答案为:Co3+;CN-;6;
(3)①CO2中C元素化合价为+4,C原子最外层4个电子全部成键,为非极性分子;
②NH3中C元素化合价为-3,N原子最外层5个电子未全部成键,为极性分子;
③CCl4中C元素化合价为+4,C原子最外层4个电子全部成键,为非极性分子;
④BF3中B元素化合价为+3,B原子最外层3个电子全部成键,为非极性分子;
⑤H2O中O元素化合价为-2,O原子最外层6个电子未全部成键,为极性分子;
⑥SO2中S元素化合价为+4,S原子最外层6个电子未全部成键,为极性分子;
⑦SO3中S元素化合价为+6,S原子最外层6个电子全部成键,为非极性分子;
⑧PCl3中P元素化合价为+3,P原子最外层5个电子未全部成键,为极性分子;
故选①③④⑦;
(4)同一元素的含氧酸,该元素的化合价越高,对应的含氧酸的酸性越强,故酸性:HClO3<HClO4;H3PO4>H3PO3,
故答案为:<;>;
(5)①NH3分子中心N原子孤电子对数=$\frac{5-1×3}{2}$=1,价层电子对数=3+1=4,故N原子采取sp3杂化,VSEPR构型为正四面体,分子的立体构型为三角锥形,
故答案为:sp3;正四面体;三角锥形;
②BF3分子中心B原子孤电子对数=$\frac{3-3×1}{2}$=0,价层电子对数=3+0=34,故B原子采取sp2杂化,VSEPR构型为平面三角形,分子的立体构型为平面三角形,
故答案为:sp2;平面三角形;
(5)水分子之间存在氢键,沸点高于同族其它元素氢化物,
故答案为:水分子之间可形成氢键.
点评 本题是对物质结构的考查,涉及核外电子排布、分子结构与性质、价层电子对互斥理论等,难度中等,侧重对基础知识巩固.

| A. | 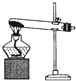 加热分解NaHCO3 | B. | 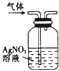 除去氯气中的少量氯化氢 | ||
| C. | 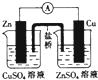 构成铜锌原电池 | D. | 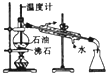 分馏石油 |
| A. | 原子半径:W>Y>Z>X | |
| B. | 最高价氧化物对应水化物的酸性:Y>W | |
| C. | 单质沸点W>Z | |
| D. | X、Y、Z不能存在与同一离子化合物中 |
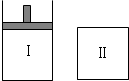 已知Ⅰ容器恒压,Ⅱ容器恒容,其它条件相同时,在Ⅰ、Ⅱ中分别加入2mol X和2mol Y,起始时Ⅰ容器、Ⅱ容器容积相同,发生反应2X(g)+2Y(g)?3Z(g)并达平衡.下列说法正确的是( )
已知Ⅰ容器恒压,Ⅱ容器恒容,其它条件相同时,在Ⅰ、Ⅱ中分别加入2mol X和2mol Y,起始时Ⅰ容器、Ⅱ容器容积相同,发生反应2X(g)+2Y(g)?3Z(g)并达平衡.下列说法正确的是( )| A. | 从起始到平衡所需时间:Ⅰ>Ⅱ | |
| B. | 达平衡时混合气体的平均摩尔质量:Ⅰ>Ⅱ | |
| C. | 平衡后若在Ⅱ中再加入0.1mol氦气,压强增大,则X的物质的量将减小 | |
| D. | 平衡时x的转化率:Ⅰ<Ⅱ |
