题目内容
以下元素基态原子电子排布图正确的是 ( )
A.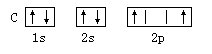 | B.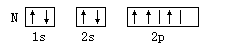 |
C. | D.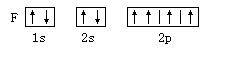 |
A
解析试题分析: 核外电子将尽可能地按能量最低原理排布,另外,由于电子不可能都挤在一起,它们还要遵守保里不相容原理和洪特规则. 在同一个原子中没有也不可能有运动状态完全相同的两个电子存在,这就是保里不相容原理故答案选A
考点:

练习册系列答案
 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案
相关题目
如下图所示,将甲、乙两个装有不同物质的针筒用导管连接起来,将乙针筒内的物质缓缓地压到甲针筒内,进行下表所列的不同实验(气体体积在常温常压下测定)。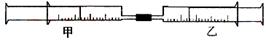
| 实验序号 | 甲针筒内物质 | 乙针筒内物质 | 甲针筒的现象 |
| 1 | 40 mL HCl | 40 mLNH3 | 产生白烟 |
| 2 | 40 mL Cl2 | 10mL 水 | 剩余气体为20mL |
| 3 | 30 mL NO | 15 mL O2 | |
| 4 | 20 mL AlCl3溶液 | 10 mL NaOH溶液 | 生成白色沉淀,后消失 |
(2)由实验2可知,常温常压下氯气在水中的溶解度为 。
(3)实验3 反应后甲针筒内气体的体积为 。
(4)实验4中,AlCl3溶液浓度为0.1mol/L,如果最后白色沉淀全部消失,则NaOH溶液浓度至少为 mol/L。
(5)将上述装置做以下改进:在甲、乙针筒之间连接一段硬质玻璃管,如下图。在A处装一种浅黄色的粉末,乙针筒内是一种常见的气体,甲针筒无气体。将乙针筒内气体压入甲针筒内,发现气体体积是原来的一半。A处的物质是 ,甲针筒内的气体为 。

(6)有学生用上述改进后的装置测定空气中氧气的体积分数(加热用酒精灯未画出)。乙针筒内装有50 mL空气。实验时,用酒精灯对A处物质进行加热,经反复慢慢推拉两针筒的活塞,反应完毕,恢复至室温,测得剩余气体为40.5mL。
①A处的物质是 (选填编号)。
a.碳粉 b.二氧化锰 c.铜粉 d.氧化铜
②已知空气中氧气的体积分数为0.2,则该实验的相对误差为 。
随着卤素原子半径的增大,下列递变规律正确的是
| A.单质的熔点逐渐降低 | B.卤素离子还原性逐渐增强 |
| C.气态氢化物稳定性逐渐增强 | D.单质氧化性逐渐增强 |
下列轨道表示式能表示氮原子的最低能量状态的是
A.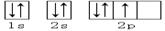 | B. |
C.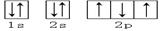 | D.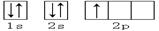 |
在元素周期表的金属元素和非金属元素交界处,最容易找到的材料是
| A.制半导体的材料 | B.耐高温、耐腐蚀的合金材料 |
| C.制农药的材料 | D.制催化剂的材料 |
X元素的阳离子和Y元素的阴离子具有相同的核外电子层结构。下列叙述中正确的是
| A.原子序数:X<Y | B.原子半径:X<Y |
| C.原子半径:X>Y | D.原子最外层电子数:X<Y |
根据原子结构及元素周期律的知识,下列推断正确的是
| A.同主族元素含氧酸的酸性随核电荷数的增加而减弱 |
| B.核外电子排布相同的微粒化学性质也相同 |
| C.Cl?、S2?、Ca2+、K+半径逐渐减小 |
D.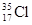 与 与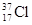 得电子能力相同 得电子能力相同 |
根据下表中部分短周期元素的原子半径及主要化合价信息:
| 元素代号 | L | M | Q | R | T |
| 原子半径/nm | 0.130 | 0.118 | 0.090 | 0.102 | 0.073 |
| 主要化合价 | +2 | +3 | +2 | +6、-2 | -2 |
A.氢化物的沸点为H2T<H2R B. L2+与R2-的核外电子数相等
C.与稀盐酸反应单质Q比单质L快 D.M与T形成的化合物具有两性
 和2mol D
和2mol D C
C