题目内容
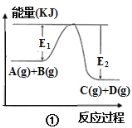
【题目】常温下,用0.05molL﹣1 KOH溶液滴定 10.00mL0.05molL﹣1 H2C2O4(二元弱酸)溶液所得滴定曲线如图(体积变化忽略不计).下列说法错误的是( )
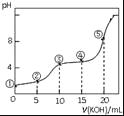
A.点②溶液中:c(K+)+c(H+)=c(HC2O4﹣)+c(C2O42﹣)+c(OH﹣)
B.点③溶液中:c(K+)=c(HC2O4﹣)+c(C2O42﹣)+c(H2C2O4)
C.点④溶液中:c(K+)+c(H2C2O4)+c(HC2O4﹣)+c(C2O42﹣)=0.05 molL﹣1
D.点⑤溶液中:c(K+)>c(HC2O4﹣)>c(C2O42﹣)>c(OH﹣)>c(H+)
【答案】AD
【解析】
A.任何电解质溶液中都存在电荷守恒,根据电荷守恒得c(K+)+c(H+)=c(HC2O4﹣)+2c(C2O42﹣)+c(OH﹣),故A错误;
B.二者恰好完全反应生成KHC2O4,该点溶液中溶质为KHC2O4,任何电解质溶液中都存在物料守恒,根据物料守恒得c(K+)=c(HC2O4﹣)+c(C2O42﹣)+c(H2C2O4),故B正确;
C.点④溶液中存在等物质的量浓度的K2C2O4和KHC2O4,由物料守恒可知,c(K+)+c(H2C2O4)+c(HC2O4﹣)+c(C2O42﹣)=![]() =0.05molL﹣1,故C正确;
=0.05molL﹣1,故C正确;
D.该点溶液中二者恰好完全反应,溶液中溶质为K2C2O4,草酸根离子水解导致溶液呈碱性,但其水解程度较小,所以c(HC2O4﹣)<c(C2O42﹣),故D错误;
故答案为AD。

【题目】某化学兴趣小组制取氯酸钾和氯水并进行有关探究实验。
实验一 制取氯酸钾和氯水
利用如图所示的实验装置进行实验。
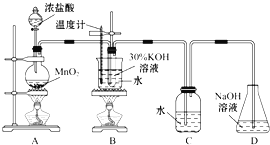
(1)制取实验结束后,取出B中试管冷却结晶,过滤,洗涤。该实验操作过程需要的玻璃仪器有______。
(2)若对调B和C装置的位置,_____(填“可能”或“不可能”)提高B中氯酸钾的产率。
实验二 氯酸钾与碘化钾反应的研究
(3)在不同条件下KClO3可将KI氧化为I2或KIO3。该小组设计了系列实验研究反应条件对反应产物的影响,其中系列a实验的记录表如下(实验在室温下进行):
试管编号 | 1 | 2 | 3 | 4 |
0.20molL-1KI/mL | 1.0 | 1.0 | 1.0 | 1.0 |
KClO3(s)/g | 0.10 | 0.10 | 0.10 | 0.10 |
6.0molL-1H2SO4/mL | 0 | 3.0 | 6.0 | 9.0 |
蒸馏水/mL | 9.0 | 6.0 | 3.0 | 0 |
实验现象 |
①系列a实验的实验目的是______。
②设计1号试管实验的作用是______。
③若2号试管实验现象是溶液变为黄色,取少量该溶液加入______溶液显蓝色。
实验三 测定饱和氯水中氯元素的总量
(4)根据下列资料,为该小组设计一个简单可行的实验方案(不必描述操作过程的细节):_____。
资料:①次氯酸会破坏酸碱指示剂;
②次氯酸或氯水可被SO2、H2O2和FeCl2等物质还原成Cl-。