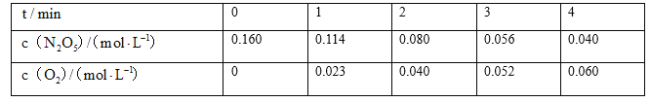
题目内容
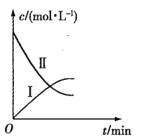
【题目】为提升电池循环效率和稳定性,科学家近期利用三维多孔海绵状Zn(3DZn)可以高效沉积ZnO的特点,设计了采用强碱性电解质的3DZn—NiOOH二次电池,结构如下图所示。电池反应为Zn(s)+2NiOOH(s)+H2O(l)![]() ZnO(s)+2Ni(OH)2(s)。
ZnO(s)+2Ni(OH)2(s)。

⑴充电时阳极反应为___。
⑵放电时负极反应为___。
⑶放电过程中OH-通过隔膜从区移向___。
【答案】Ni(OH)2(s)+OH-(aq) e- =NiOOH(s)+H2O(l) Zn(s)+2OH-(aq) 2e-=ZnO(s)+H2O(l) 从正极区移向负极区
【解析】
电池反应为Zn(s)+2NiOOH(s)+H2O(l)![]() ZnO(s)+2Ni(OH)2(s),分析得到Zn失去电子,化合价升高,NiOOH中Ni化合价降低,得到电子。
ZnO(s)+2Ni(OH)2(s),分析得到Zn失去电子,化合价升高,NiOOH中Ni化合价降低,得到电子。
⑴放电时正极为NiOOH(s) + H2O(l) + e-= Ni(OH)2(s)+OH-(aq),充电时阳极反应为Ni(OH)2(s)+OH-(aq) e- =NiOOH(s)+H2O(l);故答案为:Ni(OH)2(s)+OH-(aq) e- =NiOOH(s)+H2O(l)。
⑵放电时负极是锌失去电子,和OH-反应生成ZnO和H2O,其反应为Zn(s)+2OH-(aq) 2e-=ZnO(s)+H2O(l);故答案为:Zn(s)+2OH-(aq) 2e-=ZnO(s)+H2O(l)。
⑶放电过程中根据“异性相吸”,因此OH-通过隔膜从区移向从正极区移向负极区;故答案为:从正极区移向负极区。

练习册系列答案
相关题目