题目内容
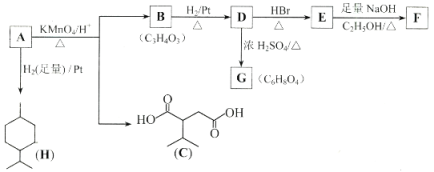
【题目】某实验探究小组研究320K时N2O5的分解反应:![]() 。如图是该小组根据所给表格中的实验数据绘制的。下列有关说法正确的是( )
。如图是该小组根据所给表格中的实验数据绘制的。下列有关说法正确的是( )
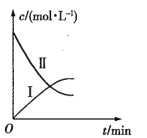
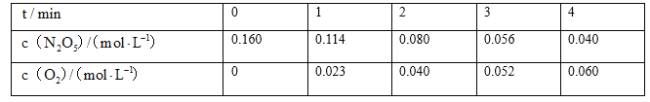
A.曲线I是N2O5的浓度变化曲线
B.曲线Ⅱ是N2O5的浓度变化曲线
C.N2O5的浓度越大,反应速率越快
D.O2的浓度越大,反应速率越快
【答案】BC
【解析】
A.由表格可知初始投料为五氧化二氮,其浓度随时间变化而减小,所以曲线II代表N2O5,曲线I代表O2,故A错误;
B.根据选项A分析可知曲线II代表N2O5,故B正确;
C.结合表格和图可知当N2O5的浓度减小时,单位时间内浓度变化减小,即反应速率减小,所以N2O5的浓度越大,反应速率越快,故C正确;
D.结合表格和图可知当O2的浓度增大时,单位时间内浓度变化减小,即反应速率减小,所以O2的浓度越大,反应速率越慢,故D错误;
故答案为BC。

练习册系列答案
 心算口算巧算一课一练系列答案
心算口算巧算一课一练系列答案
相关题目