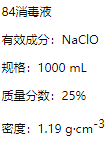
题目内容
【题目】在温度t1和t2下,X2(g)和H2反应生成HX的平衡常数如下表:
化学方程式 | K(t1) | K(t2) |
F2+H2 | 1.8×1036 | 1.9×1032 |
Cl2+H2 | 9.7×1012 | 4.2×1011 |
Br2+H2 | 5.6×107 | 9.3×106 |
I2+H2 | 43 | 34 |
(1)已知t2>t1,HX的生成反应是___反应(填“吸热”或“放热”)。
(2)HX的电子式是___。
(3)共价键的极性随共用电子对偏移程度的增大而增强,HX共价键的极性由强到弱的顺序是___。
(4)X2都能与H2反应生成HX,用原子结构解释原因:___。
(5)K的变化体现出X2化学性质的递变性,用原子结构解释原因:___,原子半径逐渐增大,得电子能力逐渐减弱。
(6)仅依据K的变化,可以推断出:随着卤素原子核电荷数的增加,___(选填字母)。
a.在相同条件下,平衡时X2的转化率逐渐降低
b.X2与H2反应的剧烈程度逐渐减弱
c.HX的还原性逐渐减弱
d.HX的稳定性逐渐减弱
【答案】放热 ![]() HF、HCl、HBr、HI 卤素原子的最外层电子数均为7 同一主族元素从上到下原子核外电子层数依次增多 ad
HF、HCl、HBr、HI 卤素原子的最外层电子数均为7 同一主族元素从上到下原子核外电子层数依次增多 ad
【解析】
(1)由表中数据可知,温度越高平衡常数越小,这说明升高温度平衡向逆反应方向移动,所以HX的生成反应是放热反应;
(2)HX属于共价化合物,H与X之间形成的化学键是极性共价键,因此HX的电子式是![]() ;
;
(3)F、Cl、Br、I属于ⅦA,同主族元素自上而下随着核电荷数的增大,原子核外电子层数逐渐增多,导致原子半径逐渐增大,因此原子核对最外层电子的吸引力逐渐减弱,从而导致非金属性逐渐减弱,即这四种元素得到电子的能力逐渐减弱,所以H﹣F键的极性最强,H﹣I的极性最弱,因此HX共价键的极性由强到弱的顺序是HF、HCl、HBr、HI;
(4)卤素原子的最外层电子数均为7个,在反应中均易得到一个电子而达到8电子的稳定结构。而H原子最外层只有一个电子,在反应中也想得到一个电子而达到2电子的稳定结构,因此卤素单质与氢气化合时易通过一对共用电子对形成化合物HX;
(5)平衡常数越大,说明反应越易进行,F、Cl、Br、I的得电子能力依次减小的主要原因是:同一主族元素从上到下原子核外电子层数依次增多,原子半径逐渐增大,核对最外层电子的吸引力依次减弱。
(6)a.K值越大,说明反应的正向程度越大,即X2的转化率越高,a正确;b.K值越大,说明反应正向进行的程度越大,不能说明反应的剧烈程度,b错误;c. HX还原性的强弱与K的大小无直接联系,c错误;d.K值越小,反应的正向程度越小,说明生成物越不稳定,越易分解,d正确;答案选ad。
故答案为:(1)放热;(2)![]() ;(3)HF、HCl、HBr、HI;(4)卤素原子的最外层电子数均为7;(5)同一主族元素从上到下原子核外电子层数依次增多;(6)ad。
;(3)HF、HCl、HBr、HI;(4)卤素原子的最外层电子数均为7;(5)同一主族元素从上到下原子核外电子层数依次增多;(6)ad。