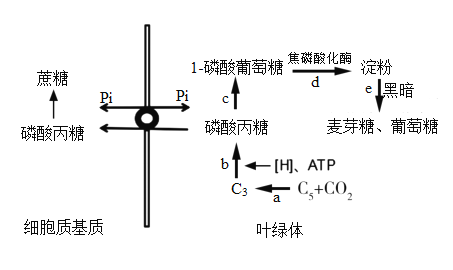
题目内容
【题目】已知某“84消毒液”瓶体部分标签如图所示,请回答下列问题:
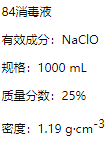
(1)该“84消毒液”的物质的量浓度约为________molL-1。(保留2位有效数字)
(2)该同学参阅该“84消毒液”的配方,欲用NaClO固体配制480 mL含NaClO质量分数为25%的消毒液。下列说法正确的是________(填字母).
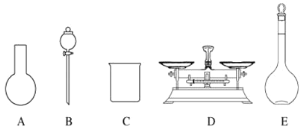
A.如图所示的仪器中,有三种是不需要的,还需要一种玻璃仪器
B.容量瓶用蒸馏水洗净后,应烘干后才能用于溶液配制
C.配制过程中,未用蒸馏水洗涤烧杯和玻璃棒可能导致结果偏低
D.需要称量NaClO固体的质量为143.0g
(3)“84消毒液”与稀硫酸混合使用可增强消毒能力,某消毒小组人员用98%(密度为1.84gcm-3)的浓硫酸配制200mL 2.3 molL-1的稀硫酸用于增强“84消毒液”的消毒能力。
①需要量取浓硫酸的体积为________mL;(保留2位有效数字)
②定容时向容量瓶中注入蒸馏水,液面离刻度线下________时,改用胶头滴管滴加蒸馏水至________相切;
③在转移液体前需要注意的是(容量瓶已查漏且洗涤干净)________________________;
④下列操作会使配制的稀硫酸物质的量浓度偏大的是________;
A.容量瓶用蒸馏水洗涤后残留有少量的水
B.量取浓溶液读数时仰视刻度线
C.移液时玻璃棒在刻度线以上
D.定容观察液体时俯视刻度线
【答案】4.0 C 25 1-2cm 凹液面和刻度线 冷却液体至室温 BD
【解析】
(1)依据c=![]() 计算溶液的物质的量浓度;
计算溶液的物质的量浓度;
(2)根据溶液的配制及c=![]() 、m=nM来分析;
、m=nM来分析;
(3)①根据溶液稀释前后溶质的物质的量不变计算;
②依据操作的规范性回答;
③浓硫酸溶于水为放热过程;
④根据c=![]() 并结合溶质的物质的量n和溶液的体积V的变化来进行误差分析。
并结合溶质的物质的量n和溶液的体积V的变化来进行误差分析。
(1)该“84消毒液”的物质的量浓度c=![]() =
=![]() =4.0mol/L;
=4.0mol/L;
故答案为:4.0;
(2)欲用NaClO固体配制480 mL含NaClO质量分数为25%的消毒液,因实验室没有480 mL的容量瓶,故需选用500mL的容量瓶,则
A.需用托盘天平称量NaClO固体,需用烧杯来溶解NaClO,需用玻璃棒进行搅拌和引流,需用容量瓶和胶头滴管来定容,图示的A和B不需要,但还需玻璃棒和胶头滴管,故A错误;
B. 容量瓶用蒸馏水洗净后,不需要烘干即可用于溶液配制,故B错误;
C. 配制过程中,未用蒸馏水洗涤烧杯和玻璃棒,则会使溶质的物质的量偏小,根据从c=![]() 可知,可能导致结果偏低,故C正确;
可知,可能导致结果偏低,故C正确;
D. 应选取500mL的容量瓶进行配制,然后取出480mL即可,所以需要NaClO的质量:0.5L×4.0molL1×74.5gmol1=149.0g,故D错误;
故答案为:C;
(3)①溶液稀释前后溶质的物质的量不变,浓硫酸的浓度为c=![]() =18.4mol/L,假设需要浓硫酸的体积为V,则V×18.4mol/L=0.2L×2.3mol/L,V=0.025L=25mL,
=18.4mol/L,假设需要浓硫酸的体积为V,则V×18.4mol/L=0.2L×2.3mol/L,V=0.025L=25mL,
故答案为:25;
②定容时向容量瓶中注入蒸馏水,液面离刻度线下1-2cm时,改用胶头滴管滴加蒸馏水至凹液面和刻度线相切,故答案为:1-2cm;凹液面和刻度线;
③在转移液体前需要注意冷却液体至室温,因浓硫酸溶于水放热,若立即转入容量瓶并加水至刻度线,根据热胀冷缩原理可知会导致溶液体积不准确,溶液浓度不准确,故答案为:冷却液体至室温;
④A.只要定容时正确,至于水是原来就有的还是后来加入的,对浓度无影响,即容量瓶未干燥即用来配制溶液,对溶液浓度无影响,不符合题意,故A错误;
B. 量取浓溶液读数时仰视刻度线,会使所量取的浓溶液偏多,溶质的物质的量偏大,最终导致结果偏大,符合题意,故B正确;
C.移液时玻璃棒在刻度线以上,会造成所配溶液的体积偏大,浓度偏低,不符合题意,故C错误;
D.定容观察液体时俯视刻度线,会导致溶液体积偏小,则浓度偏大,符合题意,故D正确;
故答案为:BD。

【题目】在温度t1和t2下,X2(g)和H2反应生成HX的平衡常数如下表:
化学方程式 | K(t1) | K(t2) |
F2+H2 | 1.8×1036 | 1.9×1032 |
Cl2+H2 | 9.7×1012 | 4.2×1011 |
Br2+H2 | 5.6×107 | 9.3×106 |
I2+H2 | 43 | 34 |
(1)已知t2>t1,HX的生成反应是___反应(填“吸热”或“放热”)。
(2)HX的电子式是___。
(3)共价键的极性随共用电子对偏移程度的增大而增强,HX共价键的极性由强到弱的顺序是___。
(4)X2都能与H2反应生成HX,用原子结构解释原因:___。
(5)K的变化体现出X2化学性质的递变性,用原子结构解释原因:___,原子半径逐渐增大,得电子能力逐渐减弱。
(6)仅依据K的变化,可以推断出:随着卤素原子核电荷数的增加,___(选填字母)。
a.在相同条件下,平衡时X2的转化率逐渐降低
b.X2与H2反应的剧烈程度逐渐减弱
c.HX的还原性逐渐减弱
d.HX的稳定性逐渐减弱