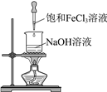
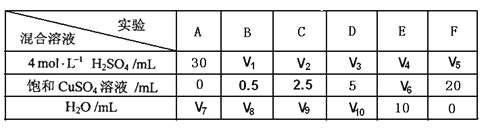
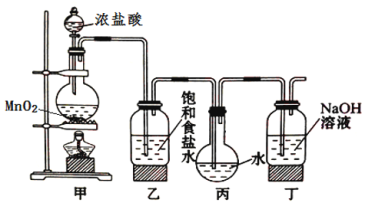
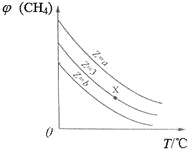
题目内容
【题目】(1)反应A(g)+B(g)![]() C(g)+D(g)过程中的能量变化如图所示,回答下列问题。
C(g)+D(g)过程中的能量变化如图所示,回答下列问题。

①该反应是____反应(填“吸热”、“放热”)。
②当反应达到平衡时,升高温度,A的转化率___(填“增大”、“减小”、“不变”),原因是____。
③反应体系中加入催化剂对反应热是否有影响?____(填“有”、“无”),原因是____。
④在反应体系中加入催化剂,反应速率增大,E1和E2的变化是:E1____,E2____(填“增大”、“减小”、“不变”)。
(2)已知由氢气和氧气反应生成1 mol水蒸气,放出241.8kJ热量。
①写出该反应的热化学方程式___。
②若1g水蒸气转化成液态水放热2.494kJ,则反应H2(g)+1/2O2(g)=H2O(l)的ΔH=_kJ·mol-1。
【答案】放热 减小 该反应正反应是放热反应,升高温度平衡向逆反应移动 无 催化剂不改变反应物总能量与生成物总能量之差即反应热不变 减小 减小 H2(g)+1/2O2(g)=H2O(g) ΔH=-241.8kJ·mol-1 -286.7
【解析】
(1)①根据图像可知,反应物的总能量大于生成物的总能量;
②正反应为放热反应,根据勒夏特列原理进行推理;
③催化剂能降低反应的活化能,对反应物及生成物的总能量无影响;
④催化剂能降低反应的活化能;
(2)①生成1 mol水蒸气时,氢气为1mol,氧气为0.5mol计算热化学方程式的焓变;
②1g水为1/18mol,则1mol水蒸汽生成液体水时释放能量=2.494kJ×18=44.892kJ,则热方程式为H2O(g)= H2O(l) ΔH=-44.892kJ/mol,根据盖斯定律计算焓变。
(1)①根据图像可知,反应物的总能量大于生成物的总能量,反应为放热反应;
②正反应为放热反应,根据勒夏特列原理,升高温度,平衡逆向移动,A的反应量减少,转化率减小;
③催化剂能降低反应的活化能,对反应物及生成物的总能量无影响,则对反应热无影响;
④催化剂能降低反应的活化能,则E1减小,反应的焓变不变,则E2减小;
(2)①生成1 mol水蒸气时,氢气为1mol,氧气为0.5mol,则热化学方程式为H2(g)+1/2O2(g)=H2O(g) ΔH=-241.8kJ/mol;
②1g水为1/18mol,则1mol水蒸汽生成液体水时释放能量=2.494kJ×18=44.892kJ,则热方程式为H2O(g)= H2O(l) ΔH=-44.892kJ/mol,根据盖斯定律,两式相加可得H2(g)+1/2O2(g)=H2O(l),则ΔH=-241.8kJ/mol-44.892kJ/mol=-286.7 kJ/mol。

 优加精卷系列答案
优加精卷系列答案【题目】已知A(g)+B(g)![]() C(g)+D(g)反应的平衡常数和温度的关系如下:
C(g)+D(g)反应的平衡常数和温度的关系如下:
|温度/ ℃ | 700 | 900 | 830 | 1000 | 1200 |
平衡常数 | 1.7 | 1.1 | 1.0 | 0.6 | 0.4 |
回答下列问题:
(1)该反应的平衡常数表达式K=____________,△H____0(填“<”“ >”“ =”);
(2)830℃时,向一个5 L的密闭容器中充入0.20mol的A和0.80mol的B,如反应初始6s内A的平均反应速率v(A)=0.003 mol·L-1·s-1。则6s时c(A)=_____mol·L-1, C的物质的量为______mol;若反应经一段时间后,达到平衡时A的转化率为_____,如果这时向该密闭容器中再充入1 mol氩气,平衡时A的转化率为_________;
(3)判断该反应是否达到平衡的依据为______(填正确选项前的字母):
a.压强不随时间改变 b.气体的密度不随时间改变
c.c(A)不随时间改变 d.单位时间里生成C和D的物质的量相等
(4)1200℃时反应C(g)+D(g)![]() A(g)+B(g)的平衡常数的值为_____________。
A(g)+B(g)的平衡常数的值为_____________。