题目内容
(8分)
A、B、C、D均为中学常见物质,其中A为单质,B、C、D为化合物 ,并且存
,并且存 在如下转换关系:
在如下转换关系: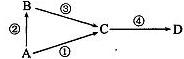
试回答下列问题:
(1)若B与C为氧化物,D为纯碱。
a.当A为非金属单质时,则反应③的化学方程式为 。
b.当A为金属单质时,则反应④中生成1mol纯碱转移电子数为 mol。
(2)若A为淡黄色非金属单质,B为气态氢化物,C为气态氧化物。 B与C反应中氧化剂与还 原剂的质量比为 。
原剂的质量比为 。
(3)若A为金属单质,B为氧化物,且反应①③均是与强碱溶液发生的反应,则反应①的离子方程式为 。

解析

练习册系列答案
相关题目
A、B、C、D均为中学常见物质且均含有同一种元素,它们之间的部分转化关系如图所示(反应条件已经略去):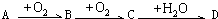 .以下推断不正确的是( )
.以下推断不正确的是( )
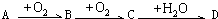 .以下推断不正确的是( )
.以下推断不正确的是( )| A、若A为溶于CS2的淡黄色固体单质,且D为强酸,则B通常用品红试剂来检验 | B、若A为喷泉实验常用的气体且其水溶液呈碱性,则D能与A反应制化肥 | C、若C为温室气体,则A与C在一定条件下反应可生成B | D、若B、C对环境造成的危害主要是光化学烟雾等,则A不可能是单质 |
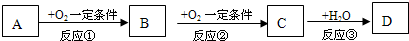
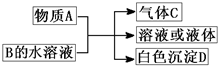 (2011?崇文区模拟)A、B、C、D均为中学化学常见物质,它们之间的反应关系如图所示.
(2011?崇文区模拟)A、B、C、D均为中学化学常见物质,它们之间的反应关系如图所示.