题目内容
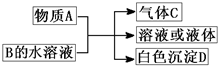 (2011?崇文区模拟)A、B、C、D均为中学化学常见物质,它们之间的反应关系如图所示.
(2011?崇文区模拟)A、B、C、D均为中学化学常见物质,它们之间的反应关系如图所示.(1)若A是碳化钙,A与B的水溶液反应时只生成气体C、CaCO3和H2O.则B(只含两种元素)的化学式为
CO2
CO2
,其固态时的晶体为分子
分子
晶体;C分子中含有的化学键类型是极性键和非极性键
极性键和非极性键
.(2)若A是短周期中原子半径最大的元素的单质,D既可溶于NaOH溶液又可溶于盐酸.请写出:
①D溶于盐酸的离子方程式
Al(OH)3+3H+=Al3++3H2O
Al(OH)3+3H+=Al3++3H2O
.②工业上冶炼A的化学方程式
2NaCl
2Na+Cl2↑
| ||
2NaCl
2Na+Cl2↑
.
| ||
③实验室用惰性电极电解100mL 0.1mol/L A的氯化物的水溶液(滴有酚酞),一段时间后,若阴阳两极均得到112mL气体(标准状况),则所得溶液的pH为
13
13
(忽略反应前后溶液的体积变化).某电极附近溶液颜色变红,原因是氢离子在阴极得到电子生成氢气,水的电离平衡被破坏,使得阴极附近氢氧根离子浓度大于氢离子浓度
氢离子在阴极得到电子生成氢气,水的电离平衡被破坏,使得阴极附近氢氧根离子浓度大于氢离子浓度
,则该电极与外接直流电源的负
负
极相连接(填“正”、或“负”).(3)若A是可溶性强碱,B是正盐,D不溶于稀硝酸,则反应的化学方程式是
Ba(OH)2+(NH4)2SO4=BaSO4↓+2NH3↑+2H2O
Ba(OH)2+(NH4)2SO4=BaSO4↓+2NH3↑+2H2O
.(4)若A常温下为红棕色气体,B是含氧酸盐,D不溶于盐酸,则D的化学式是
H2SiO3
H2SiO3
.分析:(1)碳化钙遇水会剧烈反应生成氢氧化钙和乙炔气体,生成的氢氧化钙再与B发生反应,能生成碳酸钙沉淀,B只含两种元素,只能为CO2;
(2)若A是短周期中原子半径最大的元素的单质,应为Na,工业用电解NaCl的方法冶炼,D既可溶于NaOH溶液又可溶于盐酸,应为Al(OH)3;
(3)A能与强碱反应放气体,则A为铵盐,从D不用于稀硝酸可推知D为硫酸钡,进而推知B为硫酸铵;
(4)A常温下为红棕色气体,应为NO2,与水反应生成NO和硝酸,B是含氧酸盐,与硝酸反应生成含氧酸,D不溶于盐酸,应为H2SiO3.
(2)若A是短周期中原子半径最大的元素的单质,应为Na,工业用电解NaCl的方法冶炼,D既可溶于NaOH溶液又可溶于盐酸,应为Al(OH)3;
(3)A能与强碱反应放气体,则A为铵盐,从D不用于稀硝酸可推知D为硫酸钡,进而推知B为硫酸铵;
(4)A常温下为红棕色气体,应为NO2,与水反应生成NO和硝酸,B是含氧酸盐,与硝酸反应生成含氧酸,D不溶于盐酸,应为H2SiO3.
解答:解:(1)碳化钙遇水会剧烈反应生成氢氧化钙和乙炔气体,生成的氢氧化钙再与B发生反应,能生成碳酸钙沉淀,B只含两种元素,只能为CO2,固态CO2为分子晶体,C为CH≡CH,含有极性键和非极性键,
故答案为:CO2;分子;极性键和非极性键;
(2)若A是短周期中原子半径最大的元素的单质,应为Na,工业用电解NaCl的方法冶炼,D既可溶于NaOH溶液又可溶于盐酸,应为Al(OH)3,
①Al(OH)3与盐酸反应生成Al3+,反应的离子方程式为Al(OH)3+3H+=Al3++3H2O,
故答案为:Al(OH)3+3H+=Al3++3H2O;
②工业用电解熔融的NaCl的方法冶炼Na,方程式为2NaCl
2Na+Cl2↑,故答案为:2NaCl
2Na+Cl2↑;
③电解NaCl溶液两极反应为:阳极:2Cl--2e-=Cl2↑;阴极:2H++2e-=H2↑,两极均得到112mL气体,即
=0.005mol,Cl-刚好反应完,生成2×0.005mol=0.01molOH-,则所得溶液的pH为13,阴极与电源的负极相连接,氢离子在阴极得到电子生成氢气,水的电离平衡被破坏,使得阴极附近氢氧根离子浓度大于氢离子浓度,电极附近溶液颜色变红,
故答案为:13;氢离子在阴极得到电子生成氢气,水的电离平衡被破坏,使得阴极附近氢氧根离子浓度大于氢离子浓度;负;
(3)A能与强碱反应放气体,则A为铵盐,从D不用于稀硝酸可推知D为硫酸钡,进而推知B为硫酸铵,反应的方程式为Ba(OH)2+(NH4)2SO4=BaSO4↓+2NH3↑+2H2O,
故答案为:Ba(OH)2+(NH4)2SO4=BaSO4↓+2NH3↑+2H2O;
(4)A常温下为红棕色气体,应为NO2,与水反应生成NO和硝酸,B是含氧酸盐,与硝酸反应生成含氧酸,D不溶于盐酸,应为H2SiO3,
故答案为:H2SiO3.
故答案为:CO2;分子;极性键和非极性键;
(2)若A是短周期中原子半径最大的元素的单质,应为Na,工业用电解NaCl的方法冶炼,D既可溶于NaOH溶液又可溶于盐酸,应为Al(OH)3,
①Al(OH)3与盐酸反应生成Al3+,反应的离子方程式为Al(OH)3+3H+=Al3++3H2O,
故答案为:Al(OH)3+3H+=Al3++3H2O;
②工业用电解熔融的NaCl的方法冶炼Na,方程式为2NaCl
| ||
| ||
③电解NaCl溶液两极反应为:阳极:2Cl--2e-=Cl2↑;阴极:2H++2e-=H2↑,两极均得到112mL气体,即
| 0.112L |
| 22.4L/mol |
故答案为:13;氢离子在阴极得到电子生成氢气,水的电离平衡被破坏,使得阴极附近氢氧根离子浓度大于氢离子浓度;负;
(3)A能与强碱反应放气体,则A为铵盐,从D不用于稀硝酸可推知D为硫酸钡,进而推知B为硫酸铵,反应的方程式为Ba(OH)2+(NH4)2SO4=BaSO4↓+2NH3↑+2H2O,
故答案为:Ba(OH)2+(NH4)2SO4=BaSO4↓+2NH3↑+2H2O;
(4)A常温下为红棕色气体,应为NO2,与水反应生成NO和硝酸,B是含氧酸盐,与硝酸反应生成含氧酸,D不溶于盐酸,应为H2SiO3,
故答案为:H2SiO3.
点评:本题考查无机物的推断,题目难度中等,本题易错点为(2),注意把握原电池原理,本题注意根据物质的性质结合反应现象进行推断,学习中注意相关基础知识的积累.

练习册系列答案
相关题目
 (2011?崇文区模拟)一定条件下,将一定量的A、B、C、D四种物质,置于密闭容器中发生如下反应:
(2011?崇文区模拟)一定条件下,将一定量的A、B、C、D四种物质,置于密闭容器中发生如下反应: p C(g)+q D(g)达到平衡后,测得B的浓度为0.5
p C(g)+q D(g)达到平衡后,测得B的浓度为0.5 (2011?崇文区模拟)实验室需要少量某些气体时,通常使用快速的方法制备.下列几个实验可快速制取实验室所需的少量气体,并进行相关性质实验.(实验装置如图所示)
(2011?崇文区模拟)实验室需要少量某些气体时,通常使用快速的方法制备.下列几个实验可快速制取实验室所需的少量气体,并进行相关性质实验.(实验装置如图所示)