题目内容
常温下,向20 mL 0.2 mol/L H2A溶液中滴加0.2 mol/L NaOH溶液。有关粒子的物质的量变化如图(其中Ⅰ代表H2A,Ⅱ代表HA-,Ⅲ代表A2-),根据图示判断,下列说法正确的是
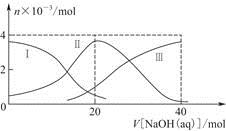

| A.当V[NaOH(aq)]=20 mL时,溶液中离子浓度大小关系: c(Na+)>c(HA-)>c(H+)>c(A2-)>c(OH-) |
| B.等体积等浓度的NaOH溶液与H2A溶液混合后,其溶液中水的电离程度比纯水大 |
| C.H2A第一步电离的方程式为H2A===HA-+H+ |
| D.向NaHA溶液加入水稀释的过程中,pH可能增大也可能减小 |
A
当V[NaOH(aq)]=20 mL时,c(HA-)>c(A2-)>c(H2A),可知NaHA的电离程度大于其水解程度,溶液显酸性,A项正确;NaHA电离出的H+抑制了水的电离,B项错误;H2A为弱酸,其电离过程是可逆的,C项错误;NaHA溶液在稀释过程中酸性降低,pH升高,D项错误。

练习册系列答案
相关题目
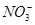
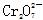 、CH3CH2OH、
、CH3CH2OH、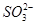
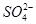
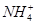 、
、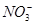 、Cl-
、Cl- 、
、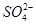 、Cl-、I-、
、Cl-、I-、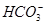 ,取该溶液进行如下实验:
,取该溶液进行如下实验: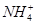 )>c(OH-)>c(H+)
)>c(OH-)>c(H+)