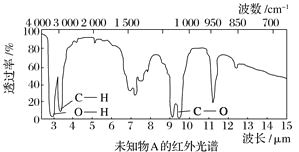
题目内容
【题目】已知HX和HY是两种一元弱酸,常温下用NaOH溶液分别滴定这两种弱酸溶液,若pKa=-lgKa,y=![]() 或lg
或lg![]() ,得到y和溶液pH的变化关系如图所示。下列有关叙述错误的是( )
,得到y和溶液pH的变化关系如图所示。下列有关叙述错误的是( )

A.常温下,Ka(HX)=10-4,Ka(HY)=10-8.5
B.a点溶液中,c(X-)=c(HX)>c(Na+)>c(H+)>c(OH-)
C.常温下,0.1mol/LNaX溶液pH大于0.1mol/LNaY溶液的pH
D.往HY溶液中滴入NaOH溶液后所得的混合溶液中,![]() =10pH-pKa(HY)
=10pH-pKa(HY)
【答案】C
【解析】
根据一元弱酸HA的电离平衡常数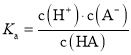 可得:
可得: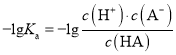 ,则
,则![]() 。
。
A.a点和b点对应的纵坐标为0,此时![]() ,a点
,a点![]() ,b点
,b点![]() ,则酸HX、XY的电离平衡常数分别为
,则酸HX、XY的电离平衡常数分别为![]() 、
、![]() ,A正确;
,A正确;
B.a点溶液呈酸性,则溶液中![]() ,根据电荷守恒可知
,根据电荷守恒可知![]() ,由于a点的纵坐标为0,则a点
,由于a点的纵坐标为0,则a点![]() ,溶液中离子浓度大小为:
,溶液中离子浓度大小为:![]() ,B正确;
,B正确;
C.根据![]() 、
、![]() 可知,HX的酸性强于HY,酸的酸性越强,对应盐的水解程度越弱,所以
可知,HX的酸性强于HY,酸的酸性越强,对应盐的水解程度越弱,所以![]() 溶液的碱性较强,pH较大,C错误;
溶液的碱性较强,pH较大,C错误;
D.根据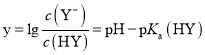 可知:
可知: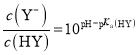 ,D正确。
,D正确。
故选C。

练习册系列答案
 金钥匙试卷系列答案
金钥匙试卷系列答案
相关题目