题目内容
12.下列化学反应既是氧化还原反应,又是反应物总能量低于生成物总能量的是( )| A. | 甲烷在氧气中的燃烧反应 | B. | 铝与稀盐酸的反应 | ||
| C. | Ba(OH)2•8H2O与NH4Cl的反应 | D. | 灼热的碳与二氧化碳的反应 |
分析 含元素化合价变化的反应,为氧化还原反应,且生成物的总能量大于反应物的总能量,为吸热反应,以此来解答.
解答 解:A.C、O元素的化合价变化,为氧化还原反应,但为放热反应,故A不选;
B.Al、H元素的化合价变化,为氧化还原反应,但为放热反应,故B不选;
C.为吸热反应,但是没有元素的化合价变化,为非氧化还原反应,故C不选;
D.C元素的化合价变化,为氧化还原反应,且为吸热反应,故D选,故选D.
点评 本题考查氧化还原反应及反应中能量变化,为高频考点,把握反应中元素的化合价变化及常见的放热、吸热反应为解答的关键,注意常见吸热反应的归纳,题目难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
3.原电池的电极名称不仅与电极材料的性质有关,也与电解质溶液有关,下列说法中不正确的是( )
| A. | 由Al、Cu、稀H2SO4组成原电池,放电时SO42-向Al电极移动 | |
| B. | 由Mg、Al、NaOH溶液组成原电池,其负极反应式为:Al-3e-+4OH-=AlO2-+2H2O | |
| C. | 由Al、Cu、浓硝酸组成原电池作电源,用石墨电极来电解硝酸银溶液,当析出1 mol Ag时,消耗铜电极32 g | |
| D. | 由Fe、Cu、FeCl3溶液组成原电池,其负极反应式为:Cu-2e-=Cu2+ |
20.下列电子式中,书写正确的是( )
| A. | 过氧化钠 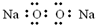 | B. | 氟化氢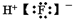 | C. | 氮气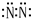 | D. | 氯化镁 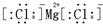 |
7.海带中富含碘元素,有人设计如下步骤来提取碘:①通足量氯气;②将海带烧成灰,向灰中加水搅拌:③加入CCl4振荡;④过滤;⑤用分液漏斗分液.合理的操作顺序为( )
| A. | ②一①一④一③一⑤ | B. | ②一④一①一③一⑤ | C. | ①一③一⑤一②一④ | D. | ③一①一②一⑤一④ |
17.可逆反应2NO2(红棕色)?2NO(无色)+O2在恒容密闭容器中反应,可以作为达到平衡状态的标志是( )
①单位时问内生成n mo1O2的同时生成2nmolNO2
②单位时间内生成n molO2的同时生成2nmolNO
③混合气体的颜色不再改变
④混合气体的密度不再改变的状态
⑤混合气体的平均相对分子质量不再改变的状态.
①单位时问内生成n mo1O2的同时生成2nmolNO2
②单位时间内生成n molO2的同时生成2nmolNO
③混合气体的颜色不再改变
④混合气体的密度不再改变的状态
⑤混合气体的平均相对分子质量不再改变的状态.
| A. | ①③④ | B. | ①③⑤ | C. | ②④⑤ | D. | ①②③④⑤ |
4.下述实验设计合理的是( )
| A. | 用锌粒和稀硝酸反应制备H2 | B. | 用NH4NO3加热制取NH3 | ||
| C. | 大理石与稀硫酸反应制备CO2 | D. | 用焰色反应鉴别固体NaCl和 KCl |
15.有机物 的正确命名为( )
的正确命名为( )
 的正确命名为( )
的正确命名为( )| A. | 3,3,4-三甲基已烷 | B. | 3,3-二甲基-4-乙基戊烷 | ||
| C. | 2-乙基-3,3-二甲基-4-乙基戊烷 | D. | 2,3,3-三甲基已烷 |
 为除去粗盐中的Ca2+、Mg2+、SO42-以及泥沙等杂质,某同学设计了一种制备精盐的实验方案,步骤如下(用于沉淀的试剂稍过量)
为除去粗盐中的Ca2+、Mg2+、SO42-以及泥沙等杂质,某同学设计了一种制备精盐的实验方案,步骤如下(用于沉淀的试剂稍过量) 用软锰矿(MnO2)、黄铁矿(FeS2)酸浸生产硫酸锰(MnSO4),并进一步制取 电解二氧化锰(EMD)的工艺流程如下:
用软锰矿(MnO2)、黄铁矿(FeS2)酸浸生产硫酸锰(MnSO4),并进一步制取 电解二氧化锰(EMD)的工艺流程如下: Fe(OH)3+3H+,加入CaCO3后,由于CaCO3(s)
Fe(OH)3+3H+,加入CaCO3后,由于CaCO3(s) Ca2+(aq)+CO32-(aq),CO32-+2H+═CO2↑+H2O,使得Fe3+的水解平衡向正反应方向移动,Fe3+转化为Fe(OH)3沉淀而被除去.
Ca2+(aq)+CO32-(aq),CO32-+2H+═CO2↑+H2O,使得Fe3+的水解平衡向正反应方向移动,Fe3+转化为Fe(OH)3沉淀而被除去.