题目内容
【题目】下面两套实验装置,都涉及金属的腐蚀反应,假设其中的金属块和金属丝都是足量的。请同学们仔细观察,完成18~19题。

(1)下列叙述正确的是
A.装置Ⅰ在反应过程中自始至终只生成红棕色气体
B.装置Ⅱ开始阶段铁丝只发生析氢腐蚀
C.装置Ⅱ在反应过程中能产生氢气
D.装置Ⅰ在反应结束时溶液中的金属阳离子只有Cu2+
(2)下列与反应原理相关的叙述不正确的是
A.装置Ⅰ中不可能发生如下反应:Fe+2Fe3+= 3Fe2+
B.装置Ⅱ在反应结束时溶液中存在Fe2+
C.装置Ⅰ的溶液若换为稀硝酸,则腐蚀过程与原装置不同
D.装置Ⅱ中的铁丝能发生电化学腐蚀
【答案】(1)C(2)A
【解析】
试题分析:(1)A.装置Ⅰ在反应过程中浓硝酸变成稀硝酸,生成NO,所以在一段时间内生成红棕色气体,过段时间后生成无色气体,A错误;B.装置Ⅱ开始阶段铁丝主要发生吸氧腐蚀,没有析氢腐蚀,B错误;C.装置Ⅱ中发生吸氧腐蚀,液面升高与铁接触,酸性条件下发生析氢腐蚀,所以在反应过程中能产生氢气,C正确;D.当浓硝酸变成稀硝酸时,Fe作负极失电子,所以溶液中还存在Fe2+,D错误,答案选C。
(2)A.铁在浓硝酸中钝化生成氧化铁,当浓硝酸变成稀硝酸时,氧化铁溶解为铁离子,铁离子与Fe发生反应:Fe+2Fe3+= 3Fe2+,A错误;B.Ⅱ中发生吸氧腐蚀,U形管左端气体减少,液面升高,稀硫酸与铁接触生成Fe2+,所以装置Ⅱ在反应结束时溶液中存在Fe2+,B正确;C.铁在浓硝酸中钝化,Cu失去电子作负极,换位稀硝酸时,铁失电子做负极,C正确;D.铁丝中含碳,有电解质溶液及氧气,能够成原电池,所以装置Ⅱ中的铁丝能发生电化学腐蚀,D正确,答案选A。

 海淀课时新作业金榜卷系列答案
海淀课时新作业金榜卷系列答案 期末金牌卷系列答案
期末金牌卷系列答案 轻松课堂标准练系列答案
轻松课堂标准练系列答案【题目】(1)锌锰干电池是一种一次电池,外壳为金属锌,中间是碳棒,其周围有碳粉,二氧化锰,氯化锌和氯化铵等组成的填充物,该电池在放电过程产生MnOOH(难溶于水),回收处理该废电池可以得到多种化工原料,有关数据下图所示:
溶解度/(g/100g水)
温度/℃ 化合物 | 0 | 20 | 40 | 60 | 80 | 100 |
NH4Cl | 29.3 | 37.2 | 45.8 | 55.3 | 65.6 | 77.3 |
ZnCl2 | 343 | 395 | 452 | 488 | 541 | 614 |
化合物 | Zn(OH)2 | Fe(OH)2 | Fe(OH)3 |
Ksp近似值 | 10-17 | 10-17 | 10-39 |
回答下列问题:
①普通锌锰电池放电时发生的主要反应为:Zn+2NH4Cl+2MnO2=Zn(NH3)2Cl2+2MnOOH。该电池中,负极材料主要是________,正极发生的主要反应式是 。
加碱调节溶液pH,使溶液中氢氧根离子浓度达到 mol/L,铁刚好完全沉淀(离子浓度小于1×10-5mol/L时,即可认为该离子沉淀完全)。继续加碱调节pH为 ,锌开始沉淀(假定Zn2+浓度为0.1mol/L)。
(2)在分析化学中常用Na2C2O4晶体(溶液无色)作为基准物质测定KMnO4溶液的浓度。在H2SO4溶液中,反应如下:2MnO+5C2O+16H+![]() 2Mn2+(溶液无色)+10CO2↑+8H2O。
2Mn2+(溶液无色)+10CO2↑+8H2O。
①若将W g Na2C2O4配成100 mL标准溶液,移取20.00 mL置于锥形瓶中,则酸性KMnO4溶液应装在__________(填“酸式”或“碱式”)滴定管中。本次滴定 选择指示剂(填“需要”、“不需要”)。判断滴定达终点的现象是____ ___。
②若滴定管起始读数和终点读数如图所示,则酸性KMnO4的物质的量浓度为_ (填表达式)。
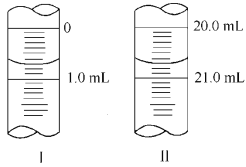
③若滴定完毕立即读数,测定的KMnO4溶液的浓度___(填“偏高”、“偏低”或“不变”)。




