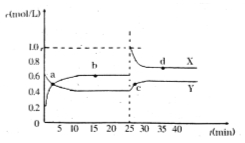
题目内容
【题目】聚酯纤维是目前产量第一的合成纤维.它可通过如下路线合成:

(1)若W的核磁共振氢谱显示有两个峰,且峰面积之比是2 :3。
① W物质的结构简式为 。
② 生成W的反应类型为 。
(2)若G的摩尔质量是116 g/mol,其分子中含C为41.4%、含O为55.2%,其余为氢元素。
① 下列叙述中不正确的有 。
a.A的同系物中可能存在顺反异构现象
b.反应I需要在NaOH的乙醇溶液中完成
c.W与A均能使酸性KMnO4溶液褪色
d.在B中滴加AgNO3溶液会马上产生淡黄色沉淀
② 完成下列化学方程式
C→D: 。
D→E: 。
C+ F→G: 。
③ J有多种同分异构体,满足以下条件J的同分异构体的个数是 ;
A.遇FeCl3溶液呈紫色 B.能发生银镜反应
C.1 mol J能与最多3 mol NaOH反应;
④ 生产中为提高产品质量,将粗品J溶于热水、趁热过滤、 ,获得J的精品。
【答案】
(1)①![]() ; ②取代;
; ②取代;
(2)① b d;
②C→D:![]() ;
;
D→E:OHC-CHO+4Ag(NH3)2OH![]() NH4OOC-COONH4+4Ag+6NH3+2H2O;
NH4OOC-COONH4+4Ag+6NH3+2H2O;
C+ F→G:HOOC—COOH+HOCH2CH2OH  +2H2O;
+2H2O;
③ 13;
④ 冷却、结晶。
【解析】
试题分析:W的核磁共振氢谱显示有两个峰,峰值面积比是2:3,由题给信息可知应为![]() ,由苯产生对二甲苯的反应类型是取代反应;J为
,由苯产生对二甲苯的反应类型是取代反应;J为![]() ,G的摩尔质量是116g/mol,其分子中含C为41.4%、含O为55.2%,其余为氢元素,则G中N(C)=(116×41.4%)÷12=4,N(H)=[116×(141.4%55.2%)]÷1=4,N(O)=(116×55.2%)÷16=4,G的分子式为C4H4O4,由转化关系可知C、F的C原子数相等,则C为HOCH2CH2OH,D为OHC-CHO,F为HOOCCOOH,则A为CH2=CH2,B为CH2BrCH2Br,该聚酯纤维为
,G的摩尔质量是116g/mol,其分子中含C为41.4%、含O为55.2%,其余为氢元素,则G中N(C)=(116×41.4%)÷12=4,N(H)=[116×(141.4%55.2%)]÷1=4,N(O)=(116×55.2%)÷16=4,G的分子式为C4H4O4,由转化关系可知C、F的C原子数相等,则C为HOCH2CH2OH,D为OHC-CHO,F为HOOCCOOH,则A为CH2=CH2,B为CH2BrCH2Br,该聚酯纤维为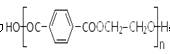 。(1)①由以上分析可知W物质的结构简式为
。(1)①由以上分析可知W物质的结构简式为![]() ;②苯和CH3Cl发生取代反应生成
;②苯和CH3Cl发生取代反应生成![]() 和HCl,反应类型是取代反应;③J为
和HCl,反应类型是取代反应;③J为![]() ,其中含有的官能团为羧基;(2)a.A为乙烯,对应同系物中可能存在顺反异构现象,如2-丁烯,正确;b.反应I为取代反应,需要在NaOH的水溶液中完成,错误;c.W为
,其中含有的官能团为羧基;(2)a.A为乙烯,对应同系物中可能存在顺反异构现象,如2-丁烯,正确;b.反应I为取代反应,需要在NaOH的水溶液中完成,错误;c.W为![]() ,与乙烯均能使酸性KMnO4溶液褪色,正确;d.B为CH2BrCH2Br,不能电离出溴离子,在B中滴加AgNO3溶液不会产生淡黄色沉淀,错误。故不正确的是b d;(3)C为HOCH2CH2OH,D为OHC-CHO,C→D的方程式为
,与乙烯均能使酸性KMnO4溶液褪色,正确;d.B为CH2BrCH2Br,不能电离出溴离子,在B中滴加AgNO3溶液不会产生淡黄色沉淀,错误。故不正确的是b d;(3)C为HOCH2CH2OH,D为OHC-CHO,C→D的方程式为![]() ;OHC-CHO含有两个醛基,可以与银氨溶液发生银镜反应产生E:NH4OOC-COONH4,所以D→E的反应方程式是:OHC-CHO+4Ag(NH3)2OH
;OHC-CHO含有两个醛基,可以与银氨溶液发生银镜反应产生E:NH4OOC-COONH4,所以D→E的反应方程式是:OHC-CHO+4Ag(NH3)2OH![]() NH4OOC-COONH4+4Ag+6NH3+2H2O;C为HOCH2CH2OH,F为HOOCCOOH,G是
NH4OOC-COONH4+4Ag+6NH3+2H2O;C为HOCH2CH2OH,F为HOOCCOOH,G是 二者可发生酯化反应,反应的方程式为HOOC—COOH+HOCH2CH2OH
二者可发生酯化反应,反应的方程式为HOOC—COOH+HOCH2CH2OH  +2H2O;③J为
+2H2O;③J为![]() ,其同分异构体具有的性质是:a.遇FeCl3溶液呈紫色,说明含有酚羟基; b.能发生银镜反应,说明含有醛基; C.1mol J能与最多3molNaOH反应,则对应的同分异构体有苯环上有-OH、-CH2OH、-OOCH等官能团,共10种同分异构体,或苯环含有2个官能团,分别为-OH和-OOCCHO,有邻、间、对3种,因此符合条件的J的同分异构体共13种;④从溶液中得到晶体,应进行溶于热水、过滤、冷却结晶等操作,故答案为:冷却、结晶。
,其同分异构体具有的性质是:a.遇FeCl3溶液呈紫色,说明含有酚羟基; b.能发生银镜反应,说明含有醛基; C.1mol J能与最多3molNaOH反应,则对应的同分异构体有苯环上有-OH、-CH2OH、-OOCH等官能团,共10种同分异构体,或苯环含有2个官能团,分别为-OH和-OOCCHO,有邻、间、对3种,因此符合条件的J的同分异构体共13种;④从溶液中得到晶体,应进行溶于热水、过滤、冷却结晶等操作,故答案为:冷却、结晶。