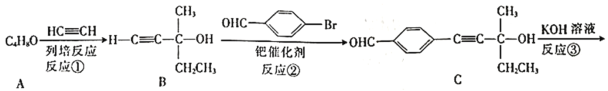
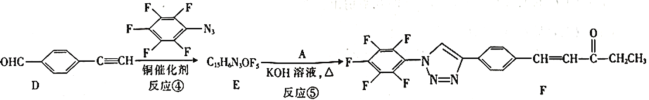
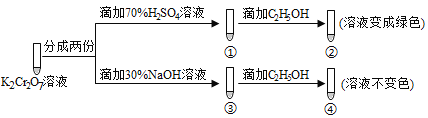
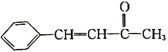题目内容
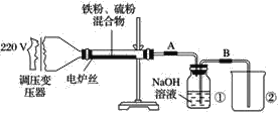
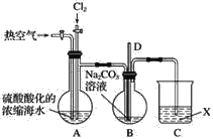
【题目】已知:Br2常温下呈液态、易挥发、有毒。如图为实验室模拟工业过程从浓缩的海水中提取溴的实验装置。
其实验步骤如下:
Ⅰ.在烧瓶中加入硫酸酸化的浓缩海水,持续通入Cl2一段时间,溶液变为浅棕色后,停止通入Cl2,改通入热空气;
Ⅱ.当A与B烧瓶溶液均变为无色的时候,停止通入热空气;
Ⅲ.将烧瓶B中的溶液倒入分液漏斗,加入稀硫酸酸化后,用CC14萃取,再经过蒸馏分离提取出其中的溴。
请回答:
(1)烧瓶A中通入Cl2过程中发生反应的离子方程式为_______________________。
(2)步骤Ⅰ中通入热空气的目的是_______________________。
(3)装置B中导管D的作用是____________________,装置C中的溶液X为____________。
(4)步骤Ⅲ中加入稀硫酸酸化发生的反应为5Br-+BrO3-+6H+===3Br2+3H2O,每生成1 mol Br2单质,转移的电子数为________mol。
【答案】Cl2+2Br-===2Cl-+Br2 使A中生成的Br2进入B瓶中 平衡压强、防止倒吸 NaOH溶液或Na2CO3溶液 ![]()
【解析】
(1)烧瓶A中通入Cl2过程中,发生氯气与海水中Br-的置换反应。
(2)步骤Ⅰ中通入热空气的目的是利用溴易挥发的性质,升高反应后海水的温度,让生成的溴单质气化进行装置内。
(3)装置B中导管D的作用是为了调节气压平衡,装置C中的溶液X是吸收未被前面装置吸收的气体。
(4)步骤Ⅲ中加入稀硫酸酸化发生的反应为5Br-+BrO3-+6H+===3Br2+3H2O,可从化合价升高或降价的某一种微粒进行分析。
(1)氯气和溴化钠反应生成溴和氯化钠,反应的离子方程式是Cl2+2Br-==2Cl-+Br2。答案为:Cl2+2Br-==2Cl-+Br2;
(2)由于溴单质易挥发,步骤Ⅰ中通入热空气的目的是使A中生成的Br2进入B瓶中。答案为:使A中生成的Br2进入B瓶中;
(3)B装置中导管D与大气相通,起到了平衡压强、防止倒吸的作用;尾气中含有有毒的氯气或溴,需要用碱液吸收,则X可以为NaOH溶液或Na2CO3溶液。答案为:平衡压强、防止倒吸;NaOH溶液或Na2CO3溶液;
(4)由方程式5Br-+BrO![]() +6H+==3Br2+3H2O,可从Br-分析,Br-中的Br由-1价升高到0价,5molBr-共失去5mole-,同时生成3molBr2,则每生成1 mol Br2单质,转移的电子数为
+6H+==3Br2+3H2O,可从Br-分析,Br-中的Br由-1价升高到0价,5molBr-共失去5mole-,同时生成3molBr2,则每生成1 mol Br2单质,转移的电子数为![]() mol。答案为:
mol。答案为:![]() 。
。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】甲醇是一种可再生能源,具有广泛的开发和应用前景。工业上一般采用下列两种反应合成甲醇。
反应Ⅰ:CO(g)+2H2(g) ![]() CH3OH(g),△H1
CH3OH(g),△H1
反应Ⅱ:C02(g)+3H2(g) ![]() CH30H(g)+ H2O(g),△H2
CH30H(g)+ H2O(g),△H2
下表所列数据是反应I在不同温度下的化学平衡常数(K):
温度 | 250℃ | 300℃ | 350℃ |
K | 2.O | 0.27 | 0.012 |
(1)由表中数据判断△H1_____0(填“>”、“<”或“=”)反应,C02(g)+H2(g)![]() CO(g)+H20(g) △H3=____(用△H1和△H2表示)。
CO(g)+H20(g) △H3=____(用△H1和△H2表示)。
(2)若容器容积不变,下列措施可提高反应Ⅰ中CO转化率的是_________(选字母)。
a.充入CO,使体系总压强增大
b.将CH3OH(g)从体系中分离
e.充入He,使体系总压强增大
d.使用高效催化剂
(3)写出反应Ⅱ的化学平衡常数表达式:K=_________;保持恒温恒容的条件下将反应Ⅱ的平衡体系各物质浓度均增加一倍,则化学平衡_________(填“正向”、“逆向”或“不”)移动,平衡常数K____(填“变大”、“变小”或“不变”)。