题目内容
【题目】元素铬及其化合物工业用途广泛,但含+6价铬的污水会损害环境。电镀厂产生的镀铜废水中往往含有一定量的Cr2O72-,处理该废水常用直接沉淀法、还原沉淀法、电解法。
I.直接沉淀法
(1)已知含铬废水中存在着平衡:![]() 。在实际工业生产中,加入沉淀剂BaCl2溶液之前还要加入一定量的NaOH,这样有利于沉淀的生成,则生成沉淀的化学式为
。在实际工业生产中,加入沉淀剂BaCl2溶液之前还要加入一定量的NaOH,这样有利于沉淀的生成,则生成沉淀的化学式为
Ⅱ.还原沉淀法
![]()
(2)下列溶液中可以代替上述流程中Na2S2O3溶液的是 (填选项序号)
A.FeSO4溶液 B.浓H2SO4溶液
C.酸性KMnO4溶液 D.Na2SO3溶液
(3)上述流程中,每消耗0.1molNa2S2O3转移0.8mole-,则加入Na2S2O3溶液时发送反应的离子方程式为
(4)Cr(OH)3的化学性质与Al(OH)3相似。在上述生产过程中加入NaOH溶液时要控制溶液的pH不能过高,原因可用离子方程式表示:
(5)实际工业生产中有时还采用阳离子交换树脂法来测定沉淀后溶液中Cr3+的含量,其原理是Mn++nNaR=nNa++MRn,其中NaR为阳离子交换树脂,Mn+为要测定的离子。
常温下,某次测定过程中,将pH=5的废水经过阳离子交换树脂后,测的溶液中Na+比交换前增加了4.6×10-2g/L,则该条件下Cr(OH)3的Ksp的值为 ,当Cr3+浓度小于10-5mol/L时可认为沉淀完全,处理后测得溶液的PH=6,则溶液过滤后 (填“能”或“否”)直接排放
Ⅲ.电解法
(6)该法是用铁作电极点解含Cr2O72-的酸性废水,电解时阴极上有大量气泡生成,并产生Cr(OH)3、Fe(OH)3沉淀,反应中1mol Cr2O72-完全生成Cr(OH)3沉淀,外电路通过的电子的物质的量为 mol
【答案】
Ⅰ、(1)BaCrO4;
Ⅱ、(2)AD;
(3)3S2O32-+4Cr2O72-+26H+═6SO42-+8Cr3++13H2O;
(4)Cr(OH)3+OH-=CrO2-+2H2O;
(5)①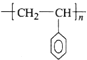 ;②6.7×10-31。
;②6.7×10-31。
【解析】
试题分析:Ⅰ、(1)含铬废水中存在着平衡:Cr2O72-+H2O2CrO42-+2H+.在实际工业生产中,加入沉淀剂BaCl2溶液之前还要加入一定量的NaOH,这样有利于沉淀的生成,氢氧根离子和氢离子反应生成水,促使平衡正向进行,有利于铬元素转化为铬酸钡沉淀,则生成沉淀的化学式为:BaCrO4;故答案为:BaCrO4;
Ⅱ、(2)可以代替上述流程中Na2S2O3溶液,需要具有还原性,能还原重铬酸根离子;A.FeSO4溶液中亚铁离子具有还原性,可以还原Cr2O72-离子,故A符合;B.浓H2SO4 具有强氧化性,不能表现还原性,不能还原Cr2O72-,故B不符合;C.酸性KMnO4 是强氧化剂不能还原Cr2O72-,故C不符合;D.Na2SO3溶液中亚硫酸根离子具有还原性,可以还原Cr2O72-,故D符合;故答案为:AD;
(3)每消耗0.1mol Na2S2O3转移0.8mol e-,Na2S2O3 ~2SO42-~8e-,Cr2O72-~2Cr3+~6e-,依据氧化还原反应电子守恒配平书写,3Na2S2O3 ~6SO42-~24e-,4Cr2O72-~8Cr3+~24e-,得到的氧化还原反应的离子方程式为:3S2O32-+4Cr2O72-+26H+═6SO42-+8Cr3++13H2O;故答案为:3S2O32-+4Cr2O72-+26H+═6SO42-+8Cr3++13H2O;
(4)在上述生产过程中加入NaOH溶液时要控制溶液的PH不能过高,Cr(OH)3的化学性质与Al(OH)3相似,Cr(OH)3可以溶解在过量的氢氧化钠溶液中,可用离子方程式表示原因为:Cr(OH)3+OH-=CrO2-+2H2O;故答案为:Cr(OH)3+OH-=CrO2-+2H2O;
(5)①聚苯乙烯是苯乙烯一定条件下发生的加成聚合反应,生成了高分子化合物聚苯乙烯,其单体为苯乙烯(![]() CH=CH2),反应为:n
CH=CH2),反应为:n![]() CH=CH2→
CH=CH2→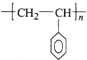 ,故答案为:
,故答案为: ;
;
②阳离子交换树脂法来测定沉淀后溶液中Cr3+的含量,其原理是Cr3++3NaR═3Na++CrR3,其中NaR为阳离子交换树脂,Mn+为要测定的离子Cr3+,Na+比交换前增加了4.6×10-2gL-1,物质的量浓度=![]() ×102mol/L=2×10-3mol/L,计算被交换的离子Cr3+浓度=
×102mol/L=2×10-3mol/L,计算被交换的离子Cr3+浓度=![]() ×2×10-3mol/L,Cr(OH)3(s)3c(OH-)+c(Cr3+),将pH=5的废水经过阳离子交换树脂后,溶液中c(OH-)=10-9mol/L,Ksp=c3(OH-)c(Cr3+)=[10-9]3×
×2×10-3mol/L,Cr(OH)3(s)3c(OH-)+c(Cr3+),将pH=5的废水经过阳离子交换树脂后,溶液中c(OH-)=10-9mol/L,Ksp=c3(OH-)c(Cr3+)=[10-9]3×![]() ×2×10-3mol/L=6.7×10-31,故答案为:6.7×10-31。
×2×10-3mol/L=6.7×10-31,故答案为:6.7×10-31。

 轻松课堂单元期中期末专题冲刺100分系列答案
轻松课堂单元期中期末专题冲刺100分系列答案