题目内容
16.某有机物能跟新制的氢氧化铜反应生成红色沉淀,相对分子质量为44.燃烧该有机物2.2g生成2.24L(标准状况下)CO2.下列说法不正确的是( )| A. | 该有机物属于醛类 | |
| B. | 燃烧该有机物4.4 g,生成1.8g水 | |
| C. | 1 mol该有机物一定条件下能与l mol H2加成 | |
| D. | 0.01 mol该有机物与足量银氨溶液充分反应,析出金属银2.16 g |
分析 某有机物能跟新制的氢氧化铜反应生成红色沉淀,相对分子质量为44,则有机物分子中O原子数目只能为1,则有机物一定含有醛基-CHO,剩余基团式量为44-29=15,为甲基,则该有机物为CH3CHO,据此解答.
解答 解:某有机物能跟新制的氢氧化铜反应生成红色沉淀,相对分子质量为44,则有机物分子中O原子数目只能为1,则有机物一定含有醛基-CHO,剩余基团式量为44-29=15,为甲基,则该有机物为CH3CHO,
A.由上述分析可知,该有机物是乙醛,属于醛类,故A正确;
B.燃烧该有机物4.4g,其物质的量为$\frac{4.4g}{44g/mol}$=0.1mol,生成水的质量为$\frac{0.1mol×4}{2}$×18g/mol=3.6g,故B错误;
C.1mol乙醛一定条件下能与1mol H2发生加成反应,故C正确;
D.由CH3CHO~2Ag可知,0.01mol该有机物与足量银氨溶液充分反应生成Ag为0.01mol×2=0.02mol,析出金属银的质量为0.02mol×108g/mol=2.16g,故D正确,
故选B.
点评 本题考查有机物分子式确定及有关计算,难度中等,判断有机物含有1个-CHO是关键,注意利用残余法确定有机物的分子式.

练习册系列答案
相关题目
6.25℃时,几种弱酸的电离常数如表:25℃时,下列说法正确的是( )
| 弱酸的化学式 | CH3COOH | HCN | H2S |
| 电离常数(25℃) | 1.8×10-5 | 4.9×10-10 | K1=1.3×10-7 K2=7.1×10-15 |
| A. | 等物质的量浓度的各溶液pH关系为:pH(CH3COONa)>pH(Na2S)>pH(NaCN) | |
| B. | NaHS和Na2S的混合溶液中,一定存在c(Na+)+c(H+)=c(OH-)+c(HS-)+2c(S2-) | |
| C. | a mol/LHCN溶液与b mol/LNaOH溶液等体积混合,所得溶液中c(Na+)>c(CN-),则a一定小于或等于b | |
| D. | 某浓度的NaCN溶液的pH=d,则其中由水电离出的c(OH-)=10-dmol/L |
7.下列关于自发反应说法正确的是( )
| A. | 一定是熵增反应 | |
| B. | 一定是焓减反应 | |
| C. | 一定是△G<0 | |
| D. | 不一定会自动进行,当给予合适条件时会自动进行 |
4.已知一定量Ca(OH)2固体溶于水后,存在以下平衡状态:Ca(OH)2(s)?Ca2+(aq)+2OH-(aq),Ksp=4.7×10-6 mol3/L3,下列措施可使Ksp增大的是( )
| A. | 升高温度 | B. | 降低温度 | ||
| C. | 加入适量CaO固体 | D. | 加入适量Na2CO3固体 |
11.金属钾晶体(如图)的结构的叙述中正确的是( )
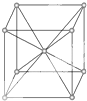

| A. | 是密置层的一种堆积方式 | B. | 晶胞是六棱柱 | ||
| C. | 每个晶胞内含2个原子 | D. | 每个晶胞内含6个原子 |
1.下列关于氯的说法正确的是( )
| A. | 氯气具有很强的氧化性,在化学反应中只能作氧化剂 | |
| B. | ${\;}_{17}^{35}$Cl、${\;}_{17}^{37}$Cl为氯元素不同的核素,具有不同的化学性质 | |
| C. | 红热的铜丝在氯气里剧烈燃烧,生成棕黄色的烟雾 | |
| D. | 氯气能与水反应生成次氯酸和盐酸,久置氯水最终变为稀盐酸 |
8.向1mo1酒石酸[HOOC(CHOH)2COOH]中加入1mol•L-1KOH溶液1L时,得最大沉淀量,再向其中加入1L上述KOH溶液时,沉淀完全溶解,下列有关叙述中,错误的是( )
| A. | 酒石酸是有机二元酸 | B. | 酒石酸与铝盐性质相似 | ||
| C. | 酒石酸氢钾的溶解度小 | D. | 酒石酸钾的溶解度大 |
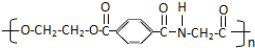 ,则这三种单体的结构简式为CH2OHCH2OH、
,则这三种单体的结构简式为CH2OHCH2OH、 、H2NCH2COOH.
、H2NCH2COOH.