题目内容
把1mL0.1mol/L的H2SO4溶液加入蒸馏水中,制成200ml溶液,稀释后的H2SO4中,由水自身电离产生的c(H+)最接近:
| A.1×10-13mol/L | B.1×10-3mol/L |
| C.1×10-7mol/L | D.1×10-11mol/L |
D
由C1V1=C2V2,得:C(稀释后H2SO4)= 5×10-4mol/L,即C酸(H+)= 1×10-3mol/L
(酸性溶液可忽略[H+]水)代入Kw=[H+][OH-],得:[OH-]=1×10-11mol/L=[OH-]水
因为: H2O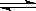 H++OH-,所以:[H+]水==[OH-]水=1×10-11mol/L,故选D
H++OH-,所以:[H+]水==[OH-]水=1×10-11mol/L,故选D
(酸性溶液可忽略[H+]水)代入Kw=[H+][OH-],得:[OH-]=1×10-11mol/L=[OH-]水
因为: H2O
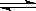 H++OH-,所以:[H+]水==[OH-]水=1×10-11mol/L,故选D
H++OH-,所以:[H+]水==[OH-]水=1×10-11mol/L,故选D
练习册系列答案
 芒果教辅达标测试卷系列答案
芒果教辅达标测试卷系列答案
相关题目
 。
。
 O2(g)= CO2(g)+2H2(g) △H2
O2(g)= CO2(g)+2H2(g) △H2

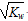 的溶液
的溶液