题目内容
【题目】在2L密闭容器内,800℃时反应:2NO(g)+O2(g)![]() 2NO2(g)体系中,n(NO)随时间的变化如表:
2NO2(g)体系中,n(NO)随时间的变化如表:
时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
n(NO)(mol) | 0.020 | 0.01. | 0.008 | 0.007 | 0.007 | 0.007 |
(1)写出该反应的平衡常数表达式:K=________________________。
已知:![]() >
>![]() ,则该反应是________热反应。
,则该反应是________热反应。
(2)如图中表示NO2的变化的曲线是_____________________。

用O2表示从0~2 s内该反应的平均速率v=_____________。
(3)能说明该反应已达到平衡状态的是__________________。
a.v(NO2)=2v(O2) b.容器内压强保持不变
c.v逆(NO)=2v正(O2) d.容器内密度保持不变
(4)为使该反应的反应速率增大,且平衡向正反应方向移动的是__________。
a.及时分离除NO2气体 b.适当升高温度
c.增大O2的浓度 d.选择高效催化剂
【答案】 ![]() 放热 b 1.5×10-3mol·L-1·s-1 bc c
放热 b 1.5×10-3mol·L-1·s-1 bc c
【解析】(1)写出该反应的平衡常数表达式:K=![]() 。已知:
。已知:![]() >
>![]() ,升高温度,K值减小,平衡逆向移动,则该反应是放热反应。(2)根据表格知,随着反应的进行,一氧化氮的物质的量减小,则平衡向正反应方向移动,二氧化氮的物质的量逐渐增大,当反应达到平衡状态时,参加反应的n(NO)=(0.020-0.007)mol=0.013mol,根据二氧化氮和一氧化氮的关系式知,平衡状态时生成n(NO2)等于参加反应的n(NO),所以平衡时c(NO2)=0.013mol/2L=0.0065mol/L,如图中表示NO2的变化的曲线是b。用O2表示从0~2 s内该反应的平均速率
,升高温度,K值减小,平衡逆向移动,则该反应是放热反应。(2)根据表格知,随着反应的进行,一氧化氮的物质的量减小,则平衡向正反应方向移动,二氧化氮的物质的量逐渐增大,当反应达到平衡状态时,参加反应的n(NO)=(0.020-0.007)mol=0.013mol,根据二氧化氮和一氧化氮的关系式知,平衡状态时生成n(NO2)等于参加反应的n(NO),所以平衡时c(NO2)=0.013mol/2L=0.0065mol/L,如图中表示NO2的变化的曲线是b。用O2表示从0~2 s内该反应的平均速率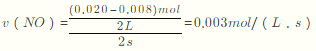 ,同一化学反应中同一时间段内,各物质的反应速率之比等于其计量数之比,所以v(O2)=1/2v(NO)=1.5×10-3mol·L-1·s-1。
,同一化学反应中同一时间段内,各物质的反应速率之比等于其计量数之比,所以v(O2)=1/2v(NO)=1.5×10-3mol·L-1·s-1。
(3)a、当v (NO2)=2v (O2)时,该反应不一定达到平衡状态,故a错误; b、该反应是一个反应气体气体体积改变的可逆反应,当达到平衡状态时,各物质的浓度不变,则容器内压强保持不变,故b正确;c、v逆(NO):v正(O2)=2:1时,该反应达到平衡状态,故c正确; d、根据质量守恒定律知,混合物质量始终不变,容器的体积不变,则容器内混合气体的密度始终不变,所以不能据此判断是否达到平衡状态,故d错误;故选:bc;
(4)a.及时分离出NO2气体,平衡向正反应移动,但反应速率降低,故a错误;b.适当升高温度,反应速率增大,平衡向逆反应移动,故b错误;c.增大O2的浓度,反应速率增大,平衡向正反应移动,故c正确;d.选择高效的催化剂,增大反应速率,不影响平衡移动,故d错误;故选c.

【题目】二氧化氯(ClO2)是极易溶于水且不与水发生化学反应的黄绿色气体,沸点为10℃,可用于饮用水净化。某小组在实验室中探究ClO2与Na2S的反应。回答下列问题:
I .ClO2的制备
己知:在强酸性溶液中用SO2还原NaC1O3能制备ClO2。

(1)反应过程中圆底烧瓶内会看到溶液中有一种白色固体析出,为了证明该物质常采用的实验操作及现象为:待实验完成、圆底烧瓶冷却后,____________________。
(2)装置B中反应的离子方程式为_________________________。
(3)欲制备并收集ClO2,选择上图中的装置,其连接顺序为a→_________(按气流方向,用小写字母表示)
(4)装置D的作用_______________。
II. ClO2与Na2S的反应

(5)将上述收集到的ClO2用N2稀释以增强其稳定性,并将适量的稀释后的ClO2通 入上图所示装置中充分反应,得到无色澄清溶液。—段时间后,通过下列实验探究I中反应的产物。
操作步骤 | 实验现象 | 结论 |
取少量Ⅰ中溶液于试管甲中,滴加品红溶液和盐酸。 | 品红始终不褪色 | ①无_____生成 |
另取少量Ⅰ中溶液于试管乙中,加入Ba(OH)2溶液,振荡 | ②________ | 有SO42-生成 |
③继续在试管乙中滴加Ba(OH)2 溶液至过量,静置,取上层清液于试管中,_______。 | 有白色沉淀生成 | 有Cl-生成 |
(6)C1O2与Na2S反应的离子方程式为_________。用于饮用水净化时,ClO2相对于Cl2的优点是______________(任写一条)。







