题目内容
常温下,有下列四种溶液:①pH=4的NH4Cl溶液;②pH=10的NaOH溶液;③pH=4的盐酸;④pH=4的醋酸溶液.请回答下列问题:
(1)溶液中①、②由水电离的c(H+) 分别为a、b,则a:b=
(2)将②与④等体积混合,所得溶液pH
(3)取等体积的③、④两种溶液,分别加水稀释到pH均等于5,所需水的体积分别为V1、V2,则V1
(4)取等体积的③、④两种溶液,加入质量不等的锌粒,反应结束后得到等量的H2,下列说法正确的是
A.反应所需时间③<④B.开始时反应速率③>④C.参加反应的锌粒质量③=④D.③中锌有剩余 E.④中锌有剩余 F.④中酸过量.
(1)溶液中①、②由水电离的c(H+) 分别为a、b,则a:b=
106:1
106:1
(2)将②与④等体积混合,所得溶液pH
<
<
7(填“>”、“<”或“=”、),溶液中离子的物质的量浓度由大到小的顺序是c(CH3COO-)>C(Na+)>c(H+)>c(OH-)
c(CH3COO-)>C(Na+)>c(H+)>c(OH-)
_.(3)取等体积的③、④两种溶液,分别加水稀释到pH均等于5,所需水的体积分别为V1、V2,则V1
<
<
V2(填“>”、“<”或“=”).(4)取等体积的③、④两种溶液,加入质量不等的锌粒,反应结束后得到等量的H2,下列说法正确的是
CDF
CDF
(填字母符号)A.反应所需时间③<④B.开始时反应速率③>④C.参加反应的锌粒质量③=④D.③中锌有剩余 E.④中锌有剩余 F.④中酸过量.
分析:(1)酸或碱抑制水电离,含有弱根离子的盐促进水电离,强酸弱碱盐溶液中氢离子就是水电离出的氢离子,碱溶液中氢离子要根据离子积常数计算;
(2)②pH=10的NaOH溶液中氢氧根离子浓度为0.0001mol/L,④pH=4的醋酸溶液中醋酸浓度大于0.0001mol/L,二者等体积混合,酸过量,溶液呈酸性;
(3)醋酸是弱电解质,稀释过程中存在电离平衡;
(4)取等体积的③、④两种溶液,加入质量不等的锌粒,反应结束后得到等量的H2,根据得失电子守恒知,反应的酸、锌的物质的量相等.
(2)②pH=10的NaOH溶液中氢氧根离子浓度为0.0001mol/L,④pH=4的醋酸溶液中醋酸浓度大于0.0001mol/L,二者等体积混合,酸过量,溶液呈酸性;
(3)醋酸是弱电解质,稀释过程中存在电离平衡;
(4)取等体积的③、④两种溶液,加入质量不等的锌粒,反应结束后得到等量的H2,根据得失电子守恒知,反应的酸、锌的物质的量相等.
解答:解:(1)酸或碱抑制水电离,含有弱根离子的盐促进水电离,强酸弱碱盐溶液中氢离子就是水电离出的氢离子,所以pH=4的NH4Cl溶液由水电离的c(H+)为10-4 mol/L,pH=10的NaOH溶液中由水电离的c(H+)
=10-10 mol/L,所以a:b=106:1,
故答案为:106:1;
(2)②pH=10的NaOH溶液中氢氧根离子浓度为0.0001mol/L,④pH=4的醋酸溶液中醋酸浓度大于0.0001mol/L,二者等体积混合,酸过量,溶液呈酸性,则c(H+)>c(OH-),根据电荷守恒知,c(CH3COO-)>C(Na+),盐醋酸钠电离程度大于水的电离程度,所以离子浓度大小顺序是:c(CH3COO-)>C(Na+)>c(H+)>c(OH-),
故答案为:<,c(CH3COO-)>C(Na+)>c(H+)>c(OH-);
(3)醋酸是弱电解质,稀释过程中存在电离平衡,促进醋酸电离,所以取等体积的③、④两种溶液,分别加水稀释到pH均等于5,所需水的体积分别为V1、V2,则V1<V2,
故答案为:<;
(4)pH相等的盐酸和醋酸,醋酸的浓度大于元素,但开始两者溶液中氢离子浓度相等,
取等体积的③、④两种溶液,则醋酸的物质的量大于盐酸,加入质量不等的锌粒,反应结束后得到等量的H2,根据得失电子守恒知,反应的酸、锌的物质的量相等,
A.反应过程中,醋酸溶液中氢离子浓度大于盐酸,所以反应所需时间③>④,故错误;
B.开始时两者氢离子浓度相等,所以反应速率③=④,故错误;
C.根据转移电子守恒知,生成相同的氢气,则参加反应的锌粒质量③=④,故正确;
D.盐酸的物质的量小于醋酸,当③中锌有剩余时,可以生成相同质量的氢气,故正确;
E.当④中锌有剩余时生成的氢气不等,故错误;
F.醋酸的物质的量大于盐酸,所以可能④中酸过量,故正确;
故选CDF.
=10-10 mol/L,所以a:b=106:1,
故答案为:106:1;
(2)②pH=10的NaOH溶液中氢氧根离子浓度为0.0001mol/L,④pH=4的醋酸溶液中醋酸浓度大于0.0001mol/L,二者等体积混合,酸过量,溶液呈酸性,则c(H+)>c(OH-),根据电荷守恒知,c(CH3COO-)>C(Na+),盐醋酸钠电离程度大于水的电离程度,所以离子浓度大小顺序是:c(CH3COO-)>C(Na+)>c(H+)>c(OH-),
故答案为:<,c(CH3COO-)>C(Na+)>c(H+)>c(OH-);
(3)醋酸是弱电解质,稀释过程中存在电离平衡,促进醋酸电离,所以取等体积的③、④两种溶液,分别加水稀释到pH均等于5,所需水的体积分别为V1、V2,则V1<V2,
故答案为:<;
(4)pH相等的盐酸和醋酸,醋酸的浓度大于元素,但开始两者溶液中氢离子浓度相等,
取等体积的③、④两种溶液,则醋酸的物质的量大于盐酸,加入质量不等的锌粒,反应结束后得到等量的H2,根据得失电子守恒知,反应的酸、锌的物质的量相等,
A.反应过程中,醋酸溶液中氢离子浓度大于盐酸,所以反应所需时间③>④,故错误;
B.开始时两者氢离子浓度相等,所以反应速率③=④,故错误;
C.根据转移电子守恒知,生成相同的氢气,则参加反应的锌粒质量③=④,故正确;
D.盐酸的物质的量小于醋酸,当③中锌有剩余时,可以生成相同质量的氢气,故正确;
E.当④中锌有剩余时生成的氢气不等,故错误;
F.醋酸的物质的量大于盐酸,所以可能④中酸过量,故正确;
故选CDF.
点评:本题考查了弱电解质的电离,明确弱电解质电离特点是解本题关键,易错点是(3)中水体积大小的判断.

练习册系列答案
 第1卷单元月考期中期末系列答案
第1卷单元月考期中期末系列答案
相关题目



 +NaHCO3→
+NaHCO3→ +CO2↑+H2O
+CO2↑+H2O
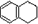 ,分子式是C10H12.常温下为无色液体,有刺激性气味,沸点207℃,不溶于水,是一种优良的溶剂,它与液溴发生反应:C10H12+4Br2→C10H8Br4+4HBr.生成的四溴化萘常温下为固态,不溶于水,有人用四氢化萘、液溴、蒸馏水和纯铁粉为原料,制备少量饱和氢溴酸溶液,实验步骤如下:
,分子式是C10H12.常温下为无色液体,有刺激性气味,沸点207℃,不溶于水,是一种优良的溶剂,它与液溴发生反应:C10H12+4Br2→C10H8Br4+4HBr.生成的四溴化萘常温下为固态,不溶于水,有人用四氢化萘、液溴、蒸馏水和纯铁粉为原料,制备少量饱和氢溴酸溶液,实验步骤如下: