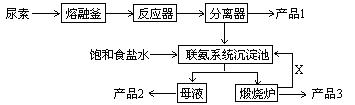
题目内容
(16分)聚合氯化铝是一种新型、高效絮凝剂和净水剂,其单体是液态的碱式氯化铝[Al2(OH)nCl6-n]。
本实验采用铝盐溶液水解絮凝法制备碱式氯化铝。其制备原料为分布广、价格廉的高岭土,化学组成为:Al2O3(25%~34%)、SiO2(40%~50%)、Fe2O3(0.5%~3.0%)以及少量杂质和水分。已知氧化铝有多种不同的结构,化学性质也有差异,且一定条件下可相互转化;高岭土中的氧化铝难溶于酸。制备碱式氯化铝的实验流程如下:

回答下列问题:
(1)“煅烧”的目的是 。
(2)“溶解”过程中发生反应的离子方程式为
(3)加少量铝粉的主要作用是 。
(4)“调节pH在4.2~4.5”的过程中,除添加必要的试剂,还需借助的实验用品是 ;“蒸发浓缩”需保持温度在90~100℃,控制温度的实 验方法是 。
验方法是 。
本实验采用铝盐溶液水解絮凝法制备碱式氯化铝。其制备原料为分布广、价格廉的高岭土,化学组成为:Al2O3(25%~34%)、SiO2(40%~50%)、Fe2O3(0.5%~3.0%)以及少量杂质和水分。已知氧化铝有多种不同的结构,化学性质也有差异,且一定条件下可相互转化;高岭土中的氧化铝难溶于酸。制备碱式氯化铝的实验流程如下:

回答下列问题:
(1)“煅烧”的目的是 。
(2)“溶解”过程中发生反应的离子方程式为
(3)加少量铝粉的主要作用是 。
(4)“调节pH在4.2~4.5”的过程中,除添加必要的试剂,还需借助的实验用品是 ;“蒸发浓缩”需保持温度在90~100℃,控制温度的实
 验方法是 。
验方法是 。(16分)
(1)改变高岭土中氧化铝的结构,使其能溶于酸。(3分)
(2)Al2O3+6H+ =2Al3++3H2O (3分) Fe2O3+6H+ =2Fe3++3H2O (3分)
(3)除去溶液中的铁离子 (3分)
(4)pH计(或精密pH试纸)(2分) 水浴加热(2分)
(1)改变高岭土中氧化铝的结构,使其能溶于酸。(3分)
(2)Al2O3+6H+ =2Al3++3H2O (3分) Fe2O3+6H+ =2Fe3++3H2O (3分)
(3)除去溶液中的铁离子 (3分)
(4)pH计(或精密pH试纸)(2分) 水浴加热(2分)
略

练习册系列答案
相关题目

 压 强 / M Pa
压 强 / M Pa 的方法是___________________________________。
的方法是___________________________________。 )是目前常用的无机储热材料,选择的依据是___________
)是目前常用的无机储热材料,选择的依据是___________ (填序号)。
(填序号)。
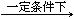 C3N6H6 + 6NH3 + 3CO2
C3N6H6 + 6NH3 + 3CO2 2NH3(g) △H=" -92.4KJ/mol " ,据此回答以下问题:
2NH3(g) △H=" -92.4KJ/mol " ,据此回答以下问题: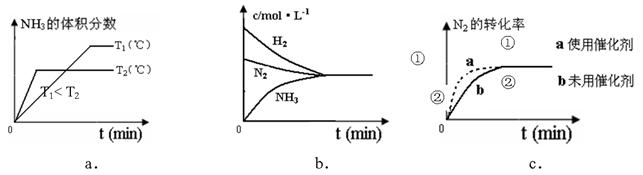
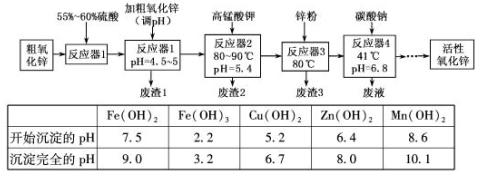
 -1
-1 重,得到ZnO 2.43g和标准状况下CO20.224l,碱式碳酸锌的化学式
重,得到ZnO 2.43g和标准状况下CO20.224l,碱式碳酸锌的化学式