题目内容
 利用催化氧化反应将SO2转化为SO3是工业上生产硫酸的关键步骤.T℃时反应2SO2(g)+O2(g)AUTOTEXT<=>\*MERGEFORMAT 错误!未找到引用源.2SO3(g)过程中的能量变化如图所示,回答下列问题.
利用催化氧化反应将SO2转化为SO3是工业上生产硫酸的关键步骤.T℃时反应2SO2(g)+O2(g)AUTOTEXT<=>\*MERGEFORMAT 错误!未找到引用源.2SO3(g)过程中的能量变化如图所示,回答下列问题.(1)T℃时将3molSO2和1molO2通入体积为2L的恒温恒容密闭容器中,发生反应.2min时反应达到平衡,此时测得反应物O2还剩余0.1mol,则达到平衡时SO2的转化率为
60%
60%
.(2)下列叙述能证明该反应已达化学平衡状态的是
①②③④
①②③④
(填序号)①SO2的体积分数不再发生变化 ②容器内压强不再发生变化 ③容器内气体分子总数不再发生变化 ④相同时间内消耗2n molSO2的同时生成n molO2 ⑤相同时间内消耗2n molSO2的同时生成2n molSO3
(3)反应
放热
放热
(填“放出”或“吸收”)E3或E2-E1
E3或E2-E1
热量(用E1、E2或E3表示).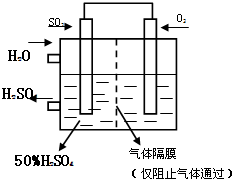
(4)若以右图所示装置,用电化学原理生产硫酸,将SO2、O2以一定压强喷到活性电极上反应.写出两电极的电极反应式:
正极:O2+4e-+4H+═2H2O
正极:O2+4e-+4H+═2H2O
;负极:SO2-2e-+2H2O═SO42-+4H+
负极:SO2-2e-+2H2O═SO42-+4H+
.为稳定持续生产,硫酸溶液的浓度应维持不变,则通入SO2和水的质量比为16:29
16:29
.分析:(1)利用三段式解题法计算参加反应的SO2的物质的量,利用转化率的定义计算.
(2)可逆反应到达平衡时,v(正)=v(逆)(同种物质)或正逆速率之比等于化学计量数之比(不同物质),反应混合物各组分的浓度不变、物质的量不变、含量为定值,以及由此衍生的一些其它量为定值,据此判断.
(3)由图可知,反应物的总能量高于生产物的总能量,所以反应放热,根据能量守恒放出的热量为E3 或E2-E1.
(4)本质为SO2与O2反应生成SO3以,SO3再与水化合生成硫酸,负极发生氧化反应,正极发生还原反应.
(2)可逆反应到达平衡时,v(正)=v(逆)(同种物质)或正逆速率之比等于化学计量数之比(不同物质),反应混合物各组分的浓度不变、物质的量不变、含量为定值,以及由此衍生的一些其它量为定值,据此判断.
(3)由图可知,反应物的总能量高于生产物的总能量,所以反应放热,根据能量守恒放出的热量为E3 或E2-E1.
(4)本质为SO2与O2反应生成SO3以,SO3再与水化合生成硫酸,负极发生氧化反应,正极发生还原反应.
解答:解:(1)2SO2(g)+O2(g)?2SO3(g)
开始 3 mol 1mol 0
转化 1.8 mol 0.9mol 1.8 mol
平衡 1.2mol 0.1mol 1.8 mol
所以SO2的转化率=
×100%=60%
故答案为:60%
(2)该反应前后气体体积减小,化学平衡状态的标志:正逆反应速率相等(同种物质)或正逆速率之比等于化学计量数之比(不同物质),反应混合物各组分的浓度不变、物质的量不变、含量为定值.
①②③④符合条件;⑤所指方向一致,故⑤错.
故选:①②④
(3)从图象知,反应物的能量大于生成物的能量,所以该反应是放热反应;
根据能量守恒放出的热量为E3 或E2-E1.
故答案为:放热;E3 或E2-E1
(4)该原电池的本质是2SO2+O2+2H2O=2H2SO4,SO2在负极上发生氧化反应电极反应式为SO2-2e-+2H2O═SO42-+4H+,O2在正极上发生还原反应电极反应式为O2+4e-+4H+═2H2O;
为维持浓度不变,SO2和O2、H2O反应生成硫酸的质量分数是50%,所需的水为反应的水和做溶剂的水,所以质量比为=2×64:(2×18+2×98)=16:29
故答案为:正极:O2+4e-+4H+═2H2O,负极:SO2-2e-+2H2O═SO42-+4H+; 16:29
开始 3 mol 1mol 0
转化 1.8 mol 0.9mol 1.8 mol
平衡 1.2mol 0.1mol 1.8 mol
所以SO2的转化率=
| 1.8mol |
| 3mol |
故答案为:60%
(2)该反应前后气体体积减小,化学平衡状态的标志:正逆反应速率相等(同种物质)或正逆速率之比等于化学计量数之比(不同物质),反应混合物各组分的浓度不变、物质的量不变、含量为定值.
①②③④符合条件;⑤所指方向一致,故⑤错.
故选:①②④
(3)从图象知,反应物的能量大于生成物的能量,所以该反应是放热反应;
根据能量守恒放出的热量为E3 或E2-E1.
故答案为:放热;E3 或E2-E1
(4)该原电池的本质是2SO2+O2+2H2O=2H2SO4,SO2在负极上发生氧化反应电极反应式为SO2-2e-+2H2O═SO42-+4H+,O2在正极上发生还原反应电极反应式为O2+4e-+4H+═2H2O;
为维持浓度不变,SO2和O2、H2O反应生成硫酸的质量分数是50%,所需的水为反应的水和做溶剂的水,所以质量比为=2×64:(2×18+2×98)=16:29
故答案为:正极:O2+4e-+4H+═2H2O,负极:SO2-2e-+2H2O═SO42-+4H+; 16:29
点评:本题考查电极反应式的书写、平衡状态的判断等知识点,难度中等,注意化学平衡状态的判断方法,是高考的热点,也是学习的难点.易错点是(4)中所需的水为反应的水和做溶剂的水,易忽略做溶剂的水.

练习册系列答案
相关题目
(1)已知1.0mol·L—1NaHSO3溶液的pH为3.5,则此溶液离子浓度从大到小的顺序为 (用离子符号表示)。
 (2)能证明Na2SO3溶液中存在水解平衡SO32-+H2O
(2)能证明Na2SO3溶液中存在水解平衡SO32-+H2O![]() HSO3-+OH-的事实是 (填序号)。
HSO3-+OH-的事实是 (填序号)。
A.滴入酚酞溶液变红,再加入H2SO4溶液红色退去
B.滴入酚酞溶液变红,再加入氯水后红色退去
C.滴入酚酞溶液变红,在加入BaCl2溶液后产生沉淀且红色退去
(3)工业上利用催化氧化反应将SO2转化为SO3:2SO2+ O2 ![]() 2SO3。若某温度下,此反应的起始浓度c(SO2)=1.0mol·L—1,c(O2)=1.5mol·L—1,达到平衡后,SO2的转化率为50%,则此温度下该反应的平衡常数K= 。
2SO3。若某温度下,此反应的起始浓度c(SO2)=1.0mol·L—1,c(O2)=1.5mol·L—1,达到平衡后,SO2的转化率为50%,则此温度下该反应的平衡常数K= 。
(4)在酸性溶液中,碘酸钾(KIO3)和亚硫酸钠可发生如下反应:
2IO3-+5SO32-+2H+===I2+5SO42-+H2O
生成的碘可以用淀粉溶液检验,根据反应溶液出现蓝色所需的时间来衡量该反应的速率。某同学设计实验如下表所示:
| 0.01mol·L-1 KIO3 酸性溶液(含淀粉)的体积/mL | 0.01mol·L-1 Na2SO3 溶液的体积/mL | H2O的体积 /mL | 实验 温度 /℃ | 溶液出现蓝色时所需时间/s | |
| 实验1 | 5 | V1 | 35 | 25 | |
| 实验2 | 5 | 5 | 40 | 25 | |
| 实验3 | 5 | 5 | V2 | 0 |
表中V2=___________mL,该实验的目的是______________ ______。

 利用催化氧化反应将SO2转化为SO3是工业上生产硫酸的关键步骤.T℃时反应2SO2(g)+O2(g)?2SO3(g)过程中的能量变化如图所示,回答下列问题.
利用催化氧化反应将SO2转化为SO3是工业上生产硫酸的关键步骤.T℃时反应2SO2(g)+O2(g)?2SO3(g)过程中的能量变化如图所示,回答下列问题.

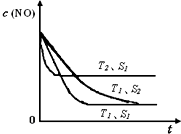 氮氧化物是大气污染物之一,消除氮氧化物的方法有多种.
氮氧化物是大气污染物之一,消除氮氧化物的方法有多种.