题目内容
(2011?厦门一模)A、B、C、D、E均为短周期元素,且原子序数依次增大;A的主族序数、周期数、原子序数均相同;B为非金属元素,其单质有多种同素异形体,其中一种可作电极材料;C是植物生长所需的主要元素之一;D和A可形成化合物A2D和A2D2,且A2D是最常见的溶剂;E原子次外层电子数等于其它层电子数之和,则:
(1)E的离子结构示意图为
 ,B、C、D、E与A形成的化合物中稳定性最强的是
,B、C、D、E与A形成的化合物中稳定性最强的是
(2)在加热和Cu作催化剂时,化合物B2A6D与D2反应的化学方程式为
(3)A~E五种元素中,含同一元素的各类物质能实现下列转化的有
(4)已知1.0mol?L-1NaAED3溶液的pH为3.5,则此溶液离子浓度从大到小的顺序为
(5)工业上利用催化氧化反应将ED2转化为ED3.若某温度下,此反应的起始浓度c(ED2)?1.0mol?L-1,c(D2)=1.5mol?L-1,达到平衡后,ED2的转化率为50%,则此温度下该反应的平衡常数K的值为
(6)在常温,常压和光照条件下,C2在催化剂(TiO2)表面与A2D反应,生成1molCA3(气体)和D2时的能量变化值为382.5kJ,此反应CA3生成量与温度的实验数据如表.则该反应的热化学方程式为

(1)E的离子结构示意图为


H2O
H2O
(填化学式);(2)在加热和Cu作催化剂时,化合物B2A6D与D2反应的化学方程式为
2C2H5OH+O2
2CH3CHO+2H2O
| ||
| △ |
2C2H5OH+O2
2CH3CHO+2H2O
;
| ||
| △ |
(3)A~E五种元素中,含同一元素的各类物质能实现下列转化的有
N、S
N、S
(填元素符号);(4)已知1.0mol?L-1NaAED3溶液的pH为3.5,则此溶液离子浓度从大到小的顺序为
Na+、HSO3-、H +、SO3 2-、OH-
Na+、HSO3-、H +、SO3 2-、OH-
(用离子符号表示);(5)工业上利用催化氧化反应将ED2转化为ED3.若某温度下,此反应的起始浓度c(ED2)?1.0mol?L-1,c(D2)=1.5mol?L-1,达到平衡后,ED2的转化率为50%,则此温度下该反应的平衡常数K的值为
0.8
0.8
;(6)在常温,常压和光照条件下,C2在催化剂(TiO2)表面与A2D反应,生成1molCA3(气体)和D2时的能量变化值为382.5kJ,此反应CA3生成量与温度的实验数据如表.则该反应的热化学方程式为
2N2 (g)+6H2O(l)=4NH3 (g)+3O2 (g)△H═+1530KJ?mol-1
2N2 (g)+6H2O(l)=4NH3 (g)+3O2 (g)△H═+1530KJ?mol-1
.| T/K | 303 | 313 | 323 |
| CA2生成量/(10-1mol) | 4.3 | 5.9 | 6.0 |
分析:短周期元素中主族序数、周期数、原子序数均相同的是H,所以A为H;非金属单质常用作电极的是碳,所以B为C;D和A可形成化合物A2D和A2D2,则D为O;植物生长所需元素是N、P、K,又A、B、C、D、E均为短周期元素,且原子序数依次增大,所以C为N;E原子次外层电子数等于其它层电子数之和,则E为第三周期元素S.
解答:解:短周期元素中主族序数、周期数、原子序数均相同的是H,所以A为H;非金属单质常用作电极的是碳,所以B为C;D和A可形成化合物A2D和A2D2,则D为O;植物生长所需元素是N、P、K,又A、B、C、D、E均为短周期元素,且原子序数依次增大,所以C为N;E原子次外层电子数等于其它层电子数之和,则E为第三周期元素S.
(1)硫离子有三个电子层,电子数依次为2、8、8,原子结构示意图为 ,C、N、O、S中非金属性O最强,所以H2O的稳定性最强,
,C、N、O、S中非金属性O最强,所以H2O的稳定性最强,
故答案为: ;H2O;
;H2O;
(2)在铜催化下,热的乙醇与氧气反应生成乙醛,反应的化学方程式为2C2H5OH+O2
2CH3CHO+2H2O,
故答案为:2C2H5OH+O2
2CH3CHO+2H2O;
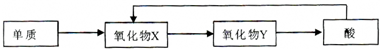
(3)单质与氧气反应生成氧化物X,X与氧气反应生成氧化物Y,Y生成酸,酸可以生成X,这样的元素必须有几种化合价,N、S可以,故答案为:N、S;
(4)NaHSO3溶液中存在的主要平衡有:HSO3 -?H++SO3 2-、HSO3 -+H2O?H2SO3+OH-、H2O?H++OH -,溶液显酸性,说明电离程度大于水解程度,故答案为Na+、HSO3-、H +、SO3 2-、OH-;
(5)达到平衡后SO2转化了50%,所以平衡时SO2浓度为0.5mol?L-1,氧气浓度为1.25mol?L-1,生成的SO3浓度为0.5mol?L-1,将各物质平衡浓度带入平衡常数表达式得到K=0.8
(6)该反应为氮气与水生成氧气和氨气,方程式为:2N2+6H2O=4NH3+3O2,生成1mol氨气吸热382.5KJ,生成4mol氨气吸热382.5×4═1530KJ,故答案为:2N2 (g)+6H2O(l)=4NH3 (g)+3O2 (g)△H═+1530KJ?mol-1
(1)硫离子有三个电子层,电子数依次为2、8、8,原子结构示意图为
 ,C、N、O、S中非金属性O最强,所以H2O的稳定性最强,
,C、N、O、S中非金属性O最强,所以H2O的稳定性最强,故答案为:
 ;H2O;
;H2O;(2)在铜催化下,热的乙醇与氧气反应生成乙醛,反应的化学方程式为2C2H5OH+O2
| ||
| △ |
故答案为:2C2H5OH+O2
| ||
| △ |
(3)单质与氧气反应生成氧化物X,X与氧气反应生成氧化物Y,Y生成酸,酸可以生成X,这样的元素必须有几种化合价,N、S可以,故答案为:N、S;
(4)NaHSO3溶液中存在的主要平衡有:HSO3 -?H++SO3 2-、HSO3 -+H2O?H2SO3+OH-、H2O?H++OH -,溶液显酸性,说明电离程度大于水解程度,故答案为Na+、HSO3-、H +、SO3 2-、OH-;
(5)达到平衡后SO2转化了50%,所以平衡时SO2浓度为0.5mol?L-1,氧气浓度为1.25mol?L-1,生成的SO3浓度为0.5mol?L-1,将各物质平衡浓度带入平衡常数表达式得到K=0.8
(6)该反应为氮气与水生成氧气和氨气,方程式为:2N2+6H2O=4NH3+3O2,生成1mol氨气吸热382.5KJ,生成4mol氨气吸热382.5×4═1530KJ,故答案为:2N2 (g)+6H2O(l)=4NH3 (g)+3O2 (g)△H═+1530KJ?mol-1
点评:考查元素推断、物质性质及方程式书写,有一定的综合性,但难度不是很大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
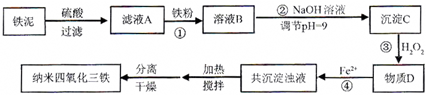
 (2011?厦门一模)常用于除去高速公路冰雪的是“氧盐类”融雪剂,如NaCl、MgCl2等.请回答
(2011?厦门一模)常用于除去高速公路冰雪的是“氧盐类”融雪剂,如NaCl、MgCl2等.请回答