题目内容
【题目】在2L密闭容器内,800℃时反应:2NO(g)+O2(g)![]() 2NO2(g)体系中,n(NO)随时间的变化如表:
2NO2(g)体系中,n(NO)随时间的变化如表:
时间(s) | 0 | 1 | 2 | 3 | 4 |
n(NO)(mol) | 0.020 | 0.01 | 0.008 | 0.007 | 0.007 |
(1)写出该反应的平衡常数表达式:K= __________,已知:K3000C>K3500C,则该反应是______热反应。
(2)图中表示NO2的变化的曲线是_____________;用O2表示从0~2 s内该反应的平均速率v=____________
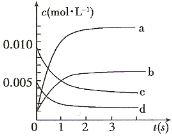
(3)能说明该反应已达到平衡状态的是____________ 。
a.v(NO2)=2v(O2) b.容器内压强保持不变
c.v逆(NO)=2v正(O2) d.容器内密度保持不变
(4)为使该反应的反应速率增大,且平衡向正反应方向移动的是____________
a.及时分离除NO2气体 b.适当升高温度
c.增大O2的浓度 d.选择高效催化剂
(5)关于该反应的下列说法中,正确的是________(填字母)。
A.ΔH>0,ΔS>0 B.ΔH>0,ΔS<0
C.ΔH<0,ΔS>0 D.ΔH<0,ΔS<0
【答案】K= c2(NO2) / c2(NO)﹒c(O2) 放热 b 1.5×10-3mol·L-1·s-1 bc c D
【解析】
(1)该反应的平衡常数表达式:K= c2(NO2) / [c2(NO)﹒c(O2)]
答案为:c2(NO2) / [c2(NO)﹒c(O2)]
已知:K3000C>K3500C,说明升高温度平衡逆向移动,所以正反应为放热反应。答案:放热
(2)从反应方程式可以看出,一氧化氮和二氧化氮的变化量应该相等。根据表中数据和图像起点可知,一氧化氮的变化曲线为c,所以图中表示NO2变化的曲线是b。答案为b
用O2表示从0~2 s内该反应的平均速率v=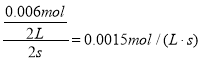
答案为1.5×10-3mol·L-1·s-1
(3)a.v(NO2)=2v(O2),不管反应进行到什么程度(反应达平衡前),此关系均成立,不一定是平衡状态;
b.因为反应前后气体的分子数不等,所以当容器内压强保持不变时,反应达平衡状态;
c.v逆(NO)=2v正(O2),此关系表明反应进行的方向相反,且数值之比等于化学计量数之比,反应达平衡状态;
d.因为气体的总质量不变,气体的体积不变,所以容器内气体的密度始终保持不变,反应不一定达平衡状态。
故答案为bc
(4)a.及时分离除NO2气体,平衡正向移动,但反应速率减慢,不合题意;
b.适当升高温度,反应速率加快,但平衡逆向移动,不合题意;
c.增大O2的浓度,反应速率加快,平衡正向移动,符合题意;
d.选择高效催化剂,反应速率加快,平衡不移动,不合题意。
答案为c
(5)该反应为体积缩小的放热反应,所以ΔH<0,ΔS<0。
答案为D。

 新活力总动员暑系列答案
新活力总动员暑系列答案 龙人图书快乐假期暑假作业郑州大学出版社系列答案
龙人图书快乐假期暑假作业郑州大学出版社系列答案