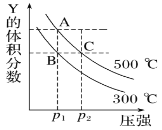
题目内容
【题目】某溶液可能含有Na+、NH4+、Ca2+、Cl–、SO42–、CO32–中的若干种。为了确定该溶液的组成,进行如下实验:
①取100 mL上述溶液,加入足量氯化钡溶液,充分反应后将沉淀过滤、洗涤、干燥,得到4.30 g固体。向该固体中加过量的稀硝酸,仍有2.33 g固体未溶解。
②向①的滤液中加入足量NaOH,加热,产生使湿润的红色石蕊试纸变蓝的气体0.448 L(气体全部逸出,且已经换算成标准状况下体积)。以下说法正确的是
A.原溶液中SO42–、CO32–和NH4+一定存在,Cl-一定不存在
B.原溶液中一定不存在Ca2+,无法判断Na+是否存在
C.原溶液中可能存在Cl-,且c(Na+) ≥ 0.200 mol· L-1
D.为确定原溶液中Cl-是否存在,可以取实验①的滤液,加硝酸酸化的AgNO3进行检验
【答案】C
【解析】
①取100 mL上述溶液,加入足量氯化钡溶液,充分反应后将沉淀过滤、洗涤、干燥,得到4.30 g固体。向该固体中加过量的稀硝酸,仍有2.33 g固体未溶解。说明白色沉淀为BaCO3和BaSO4,质量一共是4.3g,则溶液中含有CO32-、SO42-,且硫酸钡的质量是2.33g,所以硫酸根离子的物质的量是![]() =0.01mol;碳酸钡的质量是:4.3g-2.33g=1.97g,碳酸根离子的物质的量为
=0.01mol;碳酸钡的质量是:4.3g-2.33g=1.97g,碳酸根离子的物质的量为![]() =0.01mol;
=0.01mol;
②向①的滤液中加入足量的NaOH溶液,加热,产生能使湿润红色石蕊试纸变蓝的气体是氨气,物质的量是![]() =0.02mol,说明溶液中有NH4+的物质的量是0.02mol,据此分析解答。
=0.02mol,说明溶液中有NH4+的物质的量是0.02mol,据此分析解答。
A.由以上分析可知一定存在0.01mol SO42-、0.01mol CO32-、0.02mol NH4+,阴离子所带负电荷大于阳离子所带正电荷,不能确定是否含有Cl-,故A错误;
B.由以上分析可知溶液中含有CO32-、SO42-,一定不存在Ca2+,阴离子所带负电荷大于阳离子所带正电荷,一定含Na+,故B错误;
C.原溶液中可能存在Cl-,根据n(+)=n(-),即0.02+n(Na+)=2×0.01+2×0.01+ n(Cl-),据此得出n(Na+)≥ 0.02mol,体积为100mL,则c(Na+) ≥ 0.200 mol· L-1,故C正确;
D.①中加入足量氯化钡溶液,会干扰Cl-的检验,故D错误;
故选C。

 阅读快车系列答案
阅读快车系列答案【题目】在2L密闭容器内,800℃时反应:2NO(g)+O2(g)![]() 2NO2(g)体系中,n(NO)随时间的变化如表:
2NO2(g)体系中,n(NO)随时间的变化如表:
时间(s) | 0 | 1 | 2 | 3 | 4 |
n(NO)(mol) | 0.020 | 0.01 | 0.008 | 0.007 | 0.007 |
(1)写出该反应的平衡常数表达式:K= __________,已知:K3000C>K3500C,则该反应是______热反应。
(2)图中表示NO2的变化的曲线是_____________;用O2表示从0~2 s内该反应的平均速率v=____________
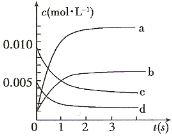
(3)能说明该反应已达到平衡状态的是____________ 。
a.v(NO2)=2v(O2) b.容器内压强保持不变
c.v逆(NO)=2v正(O2) d.容器内密度保持不变
(4)为使该反应的反应速率增大,且平衡向正反应方向移动的是____________
a.及时分离除NO2气体 b.适当升高温度
c.增大O2的浓度 d.选择高效催化剂
(5)关于该反应的下列说法中,正确的是________(填字母)。
A.ΔH>0,ΔS>0 B.ΔH>0,ΔS<0
C.ΔH<0,ΔS>0 D.ΔH<0,ΔS<0