题目内容
向Fe和Fe2O3的混合物中加入足量的稀硫酸,充分反应后生成FeSO4溶液,当生成的Fe2+和H2的物质的量之比为5︰2时,则Fe和Fe2O3的物质的量之比为
| A.3︰1 | B.1︰2 | C.2︰1 | D.1∶1 |
A
解析试题分析:假设n(H2)=2mol,则由反应:Fe+ H2SO4= FeSO4+H2↑。消耗的Fe为2mol,产生的Fe2+的物质的量为2mol.由方程式Fe2O3+3H2SO4=2Fe2(SO4)3+3H2O和Fe+2Fe2(SO4)3=3FeSO4.可得关系式Fe——Fe2O3—3Fe2+. Fe2+是3mol,所以n(Fe)=1mol,n(Fe2O3)=1mol.因此原固体中Fe和Fe2O3的物质的量之比为3:1.选项为A.
考点:考查Fe和Fe2O3的混合物与硫酸反应的知识。

NA代表阿伏加德罗常数。常温常压下二氧化碳和过氧化钠反应后,若固体质量增加了28g,对该反应的分析,错误的是
| A.反应前后物质中阴、阳离子数目保持不变 |
| B.反应前后总物质的量减少0.5mol |
| C.反应中转移了NA电子并生成了11.2L氧气 |
| D.反应的二氧化碳和生成的氧气体积比为2:1 |
建筑用的钢材在出厂前都要经过烤蓝处理,使其表面生成一层四氧化三铁,其目的是
| A.增加钢材的硬度 | B.增强钢材的抗腐蚀能力 |
| C.使钢材美观 | D.增加钢材的韧性 |
下列化合物不是黑色的是
| A.FeO | B.FeS | C.Fe3O4 | D.Fe2O3 |
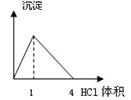
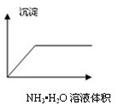
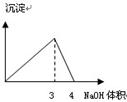
下列图像与对应的实验内容不相符的是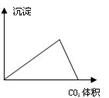
A B C D
| A.在澄清石灰水中通入CO2气体至过量 |
| B.在NaAlO2溶液中逐滴加入HCl溶液至过量 |
| C.在AlCl3溶液中逐滴加入氨水至过量 |
| D.在AlCl3溶液中逐滴加入NaOH溶液至过量 |
将物质的量相等的Na2O和Na2O2分别投入到足量且等质量的水中,得到溶质质量分数分别为a%和b%的两种溶液,则a和b的关系是
| A.a = b | B.a > b | C.a < b | D.无法确定 |
在FeCl3和CuSO4溶液中加入过量的铁粉,经过滤后测定反应前后溶液的质量不变(不计过滤损失)。则原来溶液中FeCl3和CuSO4的物质的量之比为
| A.1∶1 | B.2∶1 | C.1∶7 | D.2∶7 |
有100 mL 3 mol·L-1 NaOH溶液和100 mL 1 mol·L-1 AlCl3溶液。按如下两种方法进行实验:①将氢氧化钠溶液分多次加到AlCl3溶液中;②将AlCl3溶液分多次加到NaOH溶液中。比较两次实验的结果是( )
| A.现象相同,沉淀量相等 | B.现象不同,沉淀量不等 |
| C.现象相同,沉淀量不等 | D.现象不同,沉淀量相等 |
把4.6 g钠放入100 mL 0.1 mol/L AlCl3溶液中,待其充分反应后(水蒸发不计),下列叙述中错误的是( )
| A.Cl-浓度不变 |
| B.溶液仍有浑浊 |
| C.溶液中几乎不存在Al3+ |
| D.溶液中存在最多的离子是Na+ |