��Ŀ����
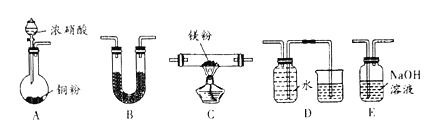
����Ŀ�����÷�Ӧ6NO2+8NH3=7N2+12H2O���ɵ�صķ���������ʵ����Ч��������������ŷţ����ỷ����Ⱦ�����ܳ�����û�ѧ�ܣ�װ����ͼ��ʾ������˵������ȷ����

A. �������Ҳ�缫�������غ��������缫
B. Ϊʹ��س����ŵ磬���ӽ���Ĥ��ѡ�������ӽ���Ĥ
C. �缫A����ӦʽΪ2NH3-6e- =N2+6H+
D. ����2.24LNO2(��״��) ������ʱ��ת�Ƶ���Ϊ0.4mol
���𰸡�C
��������
�ɷ�Ӧ6NO2+8NH3�T7N2+12H2O��֪����Ӧ��NO2Ϊ��������NH3Ϊ��ԭ������AΪ������BΪ��������������������Ӧ������������ԭ��Ӧ����ϵ������Һ�ʼ��Խ����⡣
�ɷ�Ӧ6NO2+8NH3�T7N2+12H2O��֪����Ӧ��NO2Ϊ��������NH3Ϊ��ԭ������AΪ������BΪ������
A��BΪ������AΪ����������������������������ѡ��A��ȷ��
B������ʧȥ�������ɵ����������ӣ��ڼ��Ե������Һ�У����������ƶ��������������ӽ��Ϊˮ�����Ը����ӽ���ĤӦ��������������ͨ���������������ӽ���Ĥ��ѡ��B��ȷ��
C���������Һ�ʼ��ԣ���AΪ�������缫����ʽΪ2NH3-6e-+6OH-=N2+3H2O��ѡ��C����
D������2.24L NO2����״������0.1mol ������ʱ��ת�Ƶ���Ϊ0.1mol����4-0��=0.4mol��ѡ��D��ȷ��
��ѡC��

 Сѧ���AB��ϵ�д�
Сѧ���AB��ϵ�д� ABC����ȫ�ž�ϵ�д�
ABC����ȫ�ž�ϵ�д�����Ŀ��������������������⣺
(1)��ҵ������CO��ˮ������һ�������·�����Ӧ��ȡ������
CO(g)��H2O(g) ![]() CO2(g)��H2(g) ��H����41 kJ/mol
CO2(g)��H2(g) ��H����41 kJ/mol
��֪��2H2 (g) + O2 (g) = 2H2O (g) ��H����484 kJ/mol��д��CO��ȫȼ������CO2���Ȼ�ѧ����ʽ��_______________________________________��
(2)���Ŵ�����Ⱦ���������أ������ܼ�����������ȫ�����������ŷţ��о�NO x��SO2��CO�ȴ�����Ⱦ����Ĵ���������Ҫ���塣�û���̿��ԭ��������������йط�ӦΪ:C(s)��2NO(g)![]() N2(g)��CO2(g)��ij�о�С����ij�ܱ���������һ�����Ļ���̿��NO������(T1��)�����·�Ӧ����Ӧ���е���ͬʱ���ø����ʵ�Ũ�����£�
N2(g)��CO2(g)��ij�о�С����ij�ܱ���������һ�����Ļ���̿��NO������(T1��)�����·�Ӧ����Ӧ���е���ͬʱ���ø����ʵ�Ũ�����£�
Ũ��/mol��L��1 ʱ��/min | NO | N2 | CO2 |
0 | 0.100 | 0 | 0 |
10 | 0.058 | 0.021 | 0.021 |
20 | 0.040 | 0.030 | 0.030 |
30 | 0.040 | 0.030 | 0.030 |
40 | 0.032 | 0.034 | 0.017 |
50 | 0.032 | 0.034 | 0.017 |
����ӷ�Ӧ��ʼ��20miʱ����NO��ʾ��ƽ����Ӧ����= ________�����¶��¸÷�Ӧ��ƽ�ⳣ��K��____��������λС����
��30min�ı�ijһ��������Ӧ���´ﵽƽ�⣬��ı������������_____��дһ�����ɣ���
��������������˵��������Ӧ�Ѵ�ƽ�����__________��
A�������������ƽ��Ħ���������ֲ���
B��2v(NO)��=v(N2)��
C�������������ѹǿ���ֲ���
D����λʱ��������nmolCO2��ͬʱ����2nmolNO
(3)����Fe2+��Fe3+�Ĵ����ã������½�SO2ת��ΪSO42���� ��ʵ��SO2�Ĵ������ܷ�ӦΪ2SO2+O2+2H2O��2H2SO4������֪����SO2�ķ���ͨ�뺬Fe2+��Fe3+����Һʱ������һ����Ӧ�����ӷ���ʽΪ4Fe2+ + O2+ 4H+ ��4Fe3+ + 2H2O������һ��Ӧ�����ӷ���ʽΪ_______________
(4)��ѧ��������ͼ��ʾװ����ԭ���ԭ����SO2ת��Ϊ��Ҫ�Ļ���ԭ�ϡ�

��AΪSO2��BΪO2��CΪH2SO4������ӦʽΪ_______________________________������ܷ�ӦʽΪ________________________��
����Ŀ�������ѧ���ݣ��ش��������⣺
��ijͬѧ����Ӱ����������Ը��������Һ��Ӧ�������ص��о������������Ը�����صķ�ӦΪ��2KMnO4+5H2C2O4+3H2SO4��K2SO4+2MnSO4+10CO2��+8H2O�������£���֧�Թֱܷ��Ţٺ͢ڣ�ʵ���������£�
ʵ����� | �� | �� |
�����Լ� | 4 mL 0.01mol/L���� KMnO4��Һ 2 mL 0.1mol/L H2C2O4��Һ | 4 mL 0.01mol/L���� KMnO4��Һ 2 mL 0.1mol/L H2C2O4��Һ һ���ƶ������MnSO4���� |
��ɫʱ��/s | 116 | 6 |
�Թܢ���KMnO4��Һ��ɫ�����ʿ�ʼʮ�ֻ�����һ��ʱ���ͻȻ�ӿ졣
��ش�
(1)��ʵ�������___________________________________________________________��
(2)ʵ���ѡ��MnSO4���������MnCl2�����ԭ����____________________________��
(3)��ͬѧΪʹʵ��������ܣ����Թܢ�����������ʵ�飬��Ԥ����ɫʱ��ԼΪ_____��
ʵ����� | �� |
�����Լ� | 4 mL 0.01mol/L���� KMnO4��Һ 2 mL 0.1mol/L H2C2O4��Һ һ���ƶ������Na2SO4���� |
��ɫʱ��/s |
�ζ�����һ����Ҫ�Ķ�������������Ӧ�÷�Χ�ܹ㡣ij���г������۵�һ��ʳ�þ����ΰ�װ���������²���˵����
��Ʒ�ȼ� | һ�� |
���� | ʳ�Ρ������(KIO3)������� |
�⺬��(��I��) | 20��50 mg��kg��1 |
��֪��IO3����5I����6H�� = 3I2��3H2O��I2��2S2O32- = 2I����S4O62-ijѧ����ⶨʳ�þ����εĵ⺬�����䲽��Ϊ
a��ȷ��ȡW gʳ�Σ�����������ˮʹ����ȫ�ܽ�
b����ϡ�����ữ������Һ����������KI��Һ��ʹKIO3��KI��Ӧ��ȫ
c������ָʾ������μ������ʵ���Ũ��Ϊ2.0��10/span>��3 mol��L��1��Na2S2O3��Һ10.0 mL��ǡ�÷�Ӧ��ȫ
(4)c�м����ָʾ����ѡ��_________��ǡ����ȫ��Ӧʱ��������_______________��
(5)������b�ڿ�������ʱ������������ղⶨ�IJⶨʳ�þ������еĵĵ⺬����__________(����ƫ��������ƫ��������û��Ӱ����)��
(6)��������ʵ��Ͱ�װ˵�����������ʳ�þ����εĵ⺬����(�Ժ�W�Ĵ���ʽ��ʾ)________mg��kg��1(������������������)��
����Ŀ���״���һ�ֿ�������Դ����CO2�Ʊ��״��Ĺ��̿����漰�ķ�Ӧ���£�
��Ӧ��CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) ��H1=-49.58kJ��mol-1
CH3OH(g)+H2O(g) ��H1=-49.58kJ��mol-1
��Ӧ��CO2(g)+H2(g)![]() CO(g)+H2O(g) ��H2
CO(g)+H2O(g) ��H2
��Ӧ��CO(g)+2H2(g)![]() CH3OH(g) ��H3=-90.77kJ��mol-1
CH3OH(g) ��H3=-90.77kJ��mol-1
�ش��������⣺
(1)��Ӧ��ġ�H2=_________________��
(2)��Ӧ���ܹ��Է����е�������_______________(�����ϵ��¶��� ���ϸ��¶��������κ��¶��� )��
(3)���£������ܱ������У����ڷ�Ӧ������˵������˵���÷�Ӧ�ﵽ��ѧƽ��״̬����______��
A�����������ܶȲ��ٱ仯 B����������ƽ����Է����������ٱ仯
C��CO2��H2��CH3OH��H2O�����ʵ���֮��Ϊ1��3��1��1
D���״��İٷֺ������ٱ仯
(4)���ڷ�Ӧ��ͬ�¶ȶ�CO2��ת���ʼ�������Ч��Ӱ����ͼ��ʾ�������й�˵������ȷ����__________��

A�������������䣬����ʹ�ô�������250��ʱCO2��ƽ��ת���ʿ���λ��M1
B���¶ȵ���250 ��ʱ�����¶����״��IJ�������
C��M ��ʱƽ�ⳣ����N��ʱƽ�ⳣ����
D��ʵ�ʷ�ӦӦ�������ڽϵ͵��¶��½��У������CO2��ת����
(5)��֪����������20���µ�Ksp���£��Իش��������⣺
��ѧʽ | AgCl | AgBr | AgI | Ag2S | Ag2CrO4 |
��ɫ | ��ɫ | dz��ɫ | ��ɫ | ��ɫ | ��ɫ |
Ksp | 1.8��10-10 | 5.4��10-13 | 8.3��10-17 | 6.3��10-50 | 2.0��10-12 |
��20��ʱ�������������α�����Һ�У�Ag+���ʵ���Ũ�ɴ�С��˳����____________��
����BaCl2��Һ�м���AgNO3��KBr�������ֳ�������ʱc(Br-)/c(Cl-)=________________��
�� �ⶨˮ�����Ȼ���ĺ��������ñ������������еζ����ζ�ʱ��Ӧ�����ָʾ����____��
A.KBr B��KI C��K2S D��K2CrO4
(6)��֪25��ʱKsp[Mg(OH)2]=5.6��10-12��Ksp[Cu(OH)2]=2.2��10-20��Ksp[Fe(OH)3]=4.0��10-38��Ksp[Al(OH)3]=1.1��10-33��
����25���£���Ũ�Ⱦ�Ϊ0.1 mol��L-1��AlCl3��CuCl2�����Һ����μ��백ˮ��������______________����(�ѧʽ)��
����Һ��ij�������ʵ���Ũ�ȵ���1.0��10-5 mol��L-1ʱ������Ϊ�ѳ�����ȫ������һ��Ũ�ȵ�AlCl3��FeCl3�Ļ����Һ����μ��백ˮ����Fe3+�պ���ȫ����ʱ���ⶨc(Al3+)=0.2mol��L-1����ʱ���ó�����___________(������������������������)Al(OH)3������д��������̡�