题目内容
10. 某研究性学习小组欲测定室温下(25℃、101kPa)的气体摩尔体积,请回答以下问题.该小组设计的简易实验装置如图所示:
某研究性学习小组欲测定室温下(25℃、101kPa)的气体摩尔体积,请回答以下问题.该小组设计的简易实验装置如图所示:该实验的主要操作步骤如下:
①配制100mL 1.0mol•L-1的盐酸溶液;
②用10 mL量筒(填仪器名称并注明规格)量取10.0mL 1.0mol•L-1的盐酸溶液加入锥形瓶中;
③称取a g已除去表面氧化膜的镁条,并系于铜丝末端,为使HCl全部参加反应,a的数值至少为0.12;
④往广口瓶中装入足量水,按上图连接好装置,检查装置的气密性的方法是两手掌紧贴锥形瓶外壁一会儿,如果观察到广口瓶中长导管内有一段水柱高出液面,表明装置气密性良好.
⑤反应结束后待体系温度恢复到室温,读取量筒中水的体积为VmL.
请将上述步骤补充完整并回答下列问题.
(1)用文字表述实验步骤④中检查装置气密性的方法:
(2)实验步骤⑤中应选用B(填序号)的量筒.
A.100mL B.200mL C.500mL
读数时除恢复到室温外,还要注意调节量筒高度,使量筒内的液面与集气瓶内的液面相平.
(3)若忽略水蒸气的影响,在实验条件下测得气体摩尔体积的计算公式为Vm=0.2V L•mol-1,若未除去镁条表面的氧化膜,则测量结果偏低(填“偏大”“偏小”或“无影响”).
分析 步骤②量取10.0 1.0mol•L的盐酸溶液加入锥形瓶中,量筒精确到0.1,故选用10mL量筒即可;
根据氯化氢的物质的量及化学方程式计算镁条的质量;
(1)根据压力差检验装置的气密性;
(2)Mg+2HCl═MgCl2+H2↑产生的氢气的体积即为排出的水的体积,据此选择量筒的规格;
(3)根据气体摩尔体积的计算式,Vm=$\frac{V}{n}$计算即可.
解答 解:量筒精确到0.1,题中要求酸的体积10.0mL,故选用10mL量筒即可;
步骤③
Mg+2HCl═MgCl2+H2↑
1mol 2mol
n 0.01 mol
n=0.005mol 故a=24g/mol×0.005mol=0.12g.
故答案为:10 mL量筒;0.12;
(1)根据压力差检验装置的气密性,两手掌紧贴锥形瓶外壁一会儿,如果观察到广口瓶中长导管内有一段水柱高出液面,表明装置气密性良好,故答案为:两手掌紧贴锥形瓶外壁一会儿,如果观察到广口瓶中长导管内有一段水柱高出液面,表明装置气密性良好;
(2)根据反应Mg+2HCl═MgCl2+H2↑可知0.01 molHCl,产生的氢气的体积为112mL,即为排出的水的体积O 112mL,所以要选择量筒的规格为200mL,
故选B;
(3)0.01mol氯化氢完全反应能够生成0.005mol氢气,该氢气的体积为VmL,若忽略水蒸气的影响,则在该实验条件下测得气体摩尔体积的计算式为:Vm=$\frac{V}{n}$=0.2V L•mol-1;
若未除去镁条表面的氧化膜,导致生成的氢气体积减少,则测量结果偏小,
故答案为:0.2V L•mol-1;偏小.
点评 本题主要考查常温下气体摩尔体积的测定,题目难度中等,明确实验目的及化学实验基本操作方法为解答关键,注意掌握气体摩尔体积的概念及计算方法,试题培养了学生的分析、理解能力及化学实验能力.

 时刻准备着暑假作业原子能出版社系列答案
时刻准备着暑假作业原子能出版社系列答案 暑假衔接教材期末暑假预习武汉出版社系列答案
暑假衔接教材期末暑假预习武汉出版社系列答案 假期作业暑假成长乐园新疆青少年出版社系列答案
假期作业暑假成长乐园新疆青少年出版社系列答案| A. | 标准状况下22.4L/mol 就是气体摩尔体积 | |
| B. | 非标准状况下,1mol 任何气体的体积不可能为22.4L | |
| C. | 标准状况下22.4L 任何气体都含有约6.02×1023个分子 | |
| D. | 1mol H2 和O2 的混合气体在标准状况下的体积约为44.8L |
①制作计算机芯片的材料是Si晶体,漂白液的有效成分是NaClO
②二氧化碳和氮气均是造成温室效应的气体
③食醋可去除水垢,NH4Cl溶液可去除铁锈
④SO2和NO2都能使雨水的pH<5.6,造成酸雨
⑤硅胶可用作食品干燥剂
⑥向FeCl3溶液中不断加入NaOH溶液制备Fe(OH)3胶体
⑦用铜粉和硫粉混合加热制备CuS
⑧向铝盐溶液中不断滴入烧碱溶液制备Al(OH)3.
| A. | ②③⑦ | B. | ②⑥⑦⑧ | C. | ②③⑦⑧ | D. | ①②③⑥⑧ |
| A. | 二氧化硅用于制作电脑芯片和光导纤维 | |
| B. | 硫磺用于配制黑火药和工业生产硫酸 | |
| C. | 氯气用于城市自来水消毒和生产漂白粉 | |
| D. | 钾钠合金用作原子反应堆的导热剂 |
| A. | 增大 | B. | 减小 | C. | 不变 | D. | 无法判断 |
| A. |  | B. |  | C. |  | D. |  |
| A. | 溴苯和水 | B. | 乙酸乙酯和水 | C. | 溴乙烷和乙醇 | D. | 乙醇和水 |
| A. | 将少量SO2气体通入NaClO溶液中:SO2+H2O+2ClO-=SO32-+2HClO | |
| B. | 将2molSO3气体通入一密闭容器中,达平衡后吸收QkJ热量,则该反应的热化学方程式为:2SO3(g)?2SO2(g)+O2(g)△H=+Q kJ/mol | |
| C. | 向含有0.4 mol FeBr2的溶液中通入0.3 mol Cl2充分反应:4Fe2++2Br-+3Cl2=4Fe3++6Cl-+Br2 | |
| D. | 用惰性电极电解MgCI2溶液:2 Cl-+2H2O=CI2↑+H2↑+2OH- |
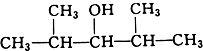 B.
B.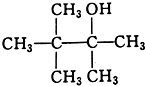
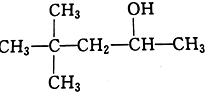 D.CH3(CH2)5CH2OH
D.CH3(CH2)5CH2OH