题目内容
下图为Mg—NaClO燃料电池结构示意图。下列说法正确的是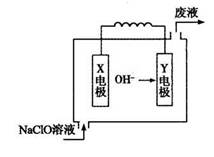
| A.镁作Y电极 |
| B.电池工作时Na+向负极移动 |
| C.废液的pH大于NaClO溶液的pH |
| D.X电极上发生的反应为:ClO—+2H2O—4e—=ClO3—+4H+ |
A
解析试题分析:A、Mg容易失去电子,OH—在燃料电池中移向流出电子的负极,故Mg作Y电极,错误;B、Na+移向流入电子的正极或X电极,错误;C、镁失去2个电子变为镁离子,镁离子与氢氧根离子结合为氢氧化镁沉淀,OH—被消耗,故废液的pH小于 NaClO溶液的pH,错误;D、H+与OH—不能大量共存,则正极反应式为ClO——4e—+4OH—=ClO3—+2H2O,错误。
考点:考查燃料电池的构成、工作原理等相关知识。

练习册系列答案
 备战中考寒假系列答案
备战中考寒假系列答案
相关题目
用石墨作电极,电解1 mol / L下列物质的溶液,溶液的pH值保持不变的是
| A.HCl | B.NaOH | C.K2SO4 | D.NaCl |
关于下图装置的叙述中正确的是( )
| A.电流由铁钉经过导线流向石墨棒 |
| B.该装置是一个简易的电解饱和食盐水的装置 |
C.石墨棒上发生的电极反应式: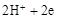 → →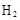 ↑ ↑ |
D.石墨棒上发生的电极反应式: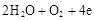 → →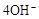 |
研究人员最近发现了一种“水”电池,这种电池能利用淡水与海水之间含盐量差别进行发电,在海水中电池总反应可表示为:5MnO2+2Ag+2NaCl=Na2Mn5O10+2AgCl。下列“水” 电池在海水中放电时的有关说法正确的是( )。
| A.正极反应式:Ag+Cl--e-=AgCl |
| B.每生成1 mol Na2Mn5O10转移2 mol电子 |
| C.Na+不断向“水”电池的负极移动 |
| D.AgCl是还原产物 |
下图为某太空站的能量转化示意图,其中燃料电池用KOH溶液为电解液。下列说法不正确的是。 
| A.水电解系统中,加入Na2 SO4可增加溶液导电性 |
| B.燃料电池的负极反应:H2+2OH一一2 e一="2" H2O |
| C.整个系统实现了物质零排放及能量间完全转化 |
D.该系统发生总反应:2H2+O2  2 H2O 2 H2O |
有关下图的说法正确的是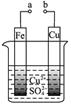
| A.构成原电池时溶液中SO42-移向Cu极 |
| B.构成原电池时Cu极反应为: Cu﹣2e-=Cu2+ |
| C.要使Fe极不被腐蚀,Cu片换Zn片或a接直流电源负极 |
| D.a和b分别接直流电源正、负极,Fe片上有气体产生 |
用Pt做电极,电解含C(Cu2+): C(Na+): C(Cl-)=1:2:4的混合溶液,在任何情况下,阴、阳两极下不可能同时发生的反应是
| A.阴极:2H++2e-=H2↑阳极:4OH-- 4e-=2H2O+O2↑ |
| B.阴极:2H++2e-=H2↑阳极:2Cl--2e-=Cl2↑ |
| C.阴极:Cu2++2e-=Cu阳极:4OH-- 4e-=2H2O+O2↑ |
| D.阴极:Cu2++2e-="Cu" 阳极:2Cl--2e-=Cl2↑ |
Cu2O 是一种半导体材料,基于绿色化学理念设计的制取Cu2O的电解池示意图如下,电解总反应为:2Cu+H2O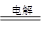 Cu2O+H2↑。下列说法正确的是
Cu2O+H2↑。下列说法正确的是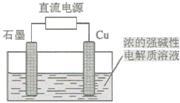
| A.石墨电极上产生氢气 |
| B.铜电极发生还原反应 |
| C.铜电极发生的电极反应为Cu—eˉ= Cu+ |
| D.当有0.2mol电子转移时,有0.1mol Cu2O生成 |
下列装置中,Fe腐蚀由快到慢的顺序为( )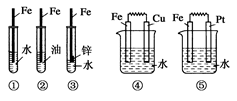
| A.⑤④③②① |
| B.⑤④①②③ |
| C.⑤③④①② |
| D.①②④③⑤ |